よむ、つかう、まなぶ。
資料1 これまでの議論で出された主な意見.pdf (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43571.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第6回 9/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
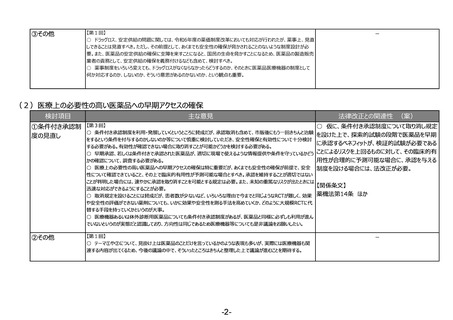
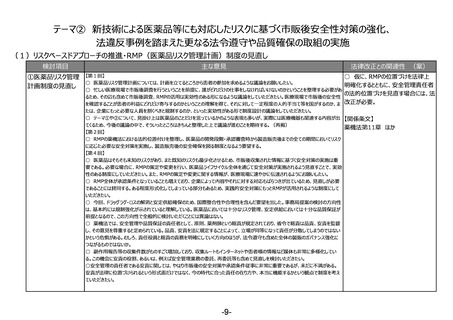
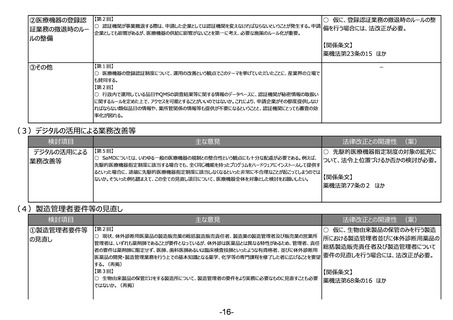
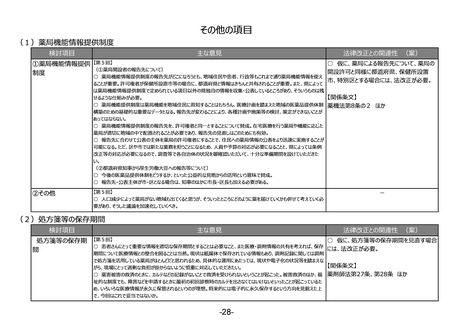
②その他
【第1回】
○ 市販後安全性調査に関して、早期承認や緊急承認等をして、いち早く供給をしたまではいいものの、その後の安全性、有効性の再
確認に資するようなデータの蓄積と、その内容の標準化が明確に確認できるきちんとした信頼性の高いデータベースが、いまだに十分に存
在していないようにも思われる。長年の指摘事項であるため、改めて御検討いただきたい。
-
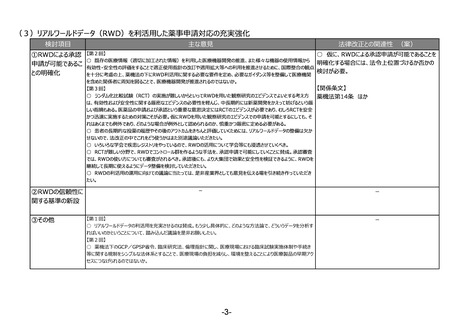
(2)RWDの安全対策への利活用の明確化
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、薬機法の再審査申請におい
リアルワールドデータ 【第1回】
○ リアルワールドデータの利活用を充実させるのは賛成。もう少し具体的に、どのような方法論で、どういうデータを分析すればいいのかと
てリアルワールドデータの活用を促進す
の安全対策への利活
いうことについて、踏み込んだ議論を是非お願いしたい。(再掲)
る場合には、法改正が必要。
用の明確化
【第3回】
○ 承認後にも、より大集団で効果と安全性を検証できるように、RWDを継続して長期に使えるようにデータ整備を検討していただきた
い。(再掲)
【関係条文】
薬機法第14条の4 ほか
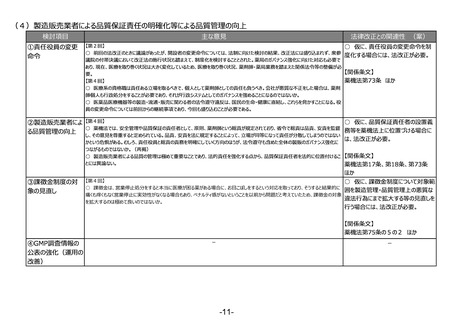
(3)安全性情報報告制度等の重点化の推進
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、感染症定期報告の見直し
①安全性情報報告 【第2回】
○ 国際整合性・合理性の観点から各種副作用報告等制度を見直し、医薬品ごとのリスクに応じた安全対策を行う制度となるよう検
を行う場合には、法改正が必要。
制度等の重点化の推
討いただきたい。
進
○ 外国症例の既知の個別症例報告を不要とし、その人的資源をより詳細な情報が収集でき具体的な対策を検討できる国内症例や
未知事象等の重点的に処理すべき案件へフォーカスすることが可能となり、より具体的かつ的確・迅速な国内の安全対策および保健衛
生の向上により貢献できると考える。
【第4回】
○ 感染症定期報告については、重複して同じような報告が上がってくるということで、運用の部分で見直しが必要であることは賛成だ
が、この制度の重要性については引き続きご理解いただきたい。
○ 投与経路が異なるものについても重複報告をなくすことについて、安全対策上問題がないようであれば異論はない。
②その他
【第2回】
○ ICT/DXの進歩を踏まえ、MR活動は実質、医療機関への直接訪問だけではなくなってきている。GVP省令における医療機関等へ
の情報提供のあり方について、時代に沿った見直しも必要ではないか。
-10-
【関係条文】
薬機法第68条の14、第68条の24
ほか
-
【第1回】
○ 市販後安全性調査に関して、早期承認や緊急承認等をして、いち早く供給をしたまではいいものの、その後の安全性、有効性の再
確認に資するようなデータの蓄積と、その内容の標準化が明確に確認できるきちんとした信頼性の高いデータベースが、いまだに十分に存
在していないようにも思われる。長年の指摘事項であるため、改めて御検討いただきたい。
-
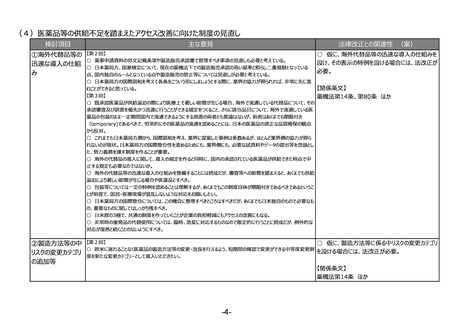
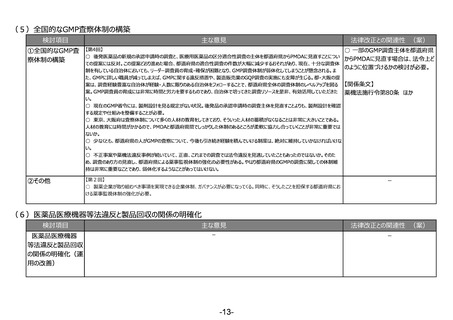
(2)RWDの安全対策への利活用の明確化
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、薬機法の再審査申請におい
リアルワールドデータ 【第1回】
○ リアルワールドデータの利活用を充実させるのは賛成。もう少し具体的に、どのような方法論で、どういうデータを分析すればいいのかと
てリアルワールドデータの活用を促進す
の安全対策への利活
いうことについて、踏み込んだ議論を是非お願いしたい。(再掲)
る場合には、法改正が必要。
用の明確化
【第3回】
○ 承認後にも、より大集団で効果と安全性を検証できるように、RWDを継続して長期に使えるようにデータ整備を検討していただきた
い。(再掲)
【関係条文】
薬機法第14条の4 ほか
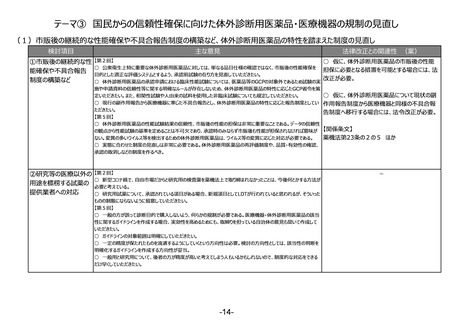
(3)安全性情報報告制度等の重点化の推進
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、感染症定期報告の見直し
①安全性情報報告 【第2回】
○ 国際整合性・合理性の観点から各種副作用報告等制度を見直し、医薬品ごとのリスクに応じた安全対策を行う制度となるよう検
を行う場合には、法改正が必要。
制度等の重点化の推
討いただきたい。
進
○ 外国症例の既知の個別症例報告を不要とし、その人的資源をより詳細な情報が収集でき具体的な対策を検討できる国内症例や
未知事象等の重点的に処理すべき案件へフォーカスすることが可能となり、より具体的かつ的確・迅速な国内の安全対策および保健衛
生の向上により貢献できると考える。
【第4回】
○ 感染症定期報告については、重複して同じような報告が上がってくるということで、運用の部分で見直しが必要であることは賛成だ
が、この制度の重要性については引き続きご理解いただきたい。
○ 投与経路が異なるものについても重複報告をなくすことについて、安全対策上問題がないようであれば異論はない。
②その他
【第2回】
○ ICT/DXの進歩を踏まえ、MR活動は実質、医療機関への直接訪問だけではなくなってきている。GVP省令における医療機関等へ
の情報提供のあり方について、時代に沿った見直しも必要ではないか。
-10-
【関係条文】
薬機法第68条の14、第68条の24
ほか
-