よむ、つかう、まなぶ。
資料1 これまでの議論で出された主な意見.pdf (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43571.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第6回 9/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
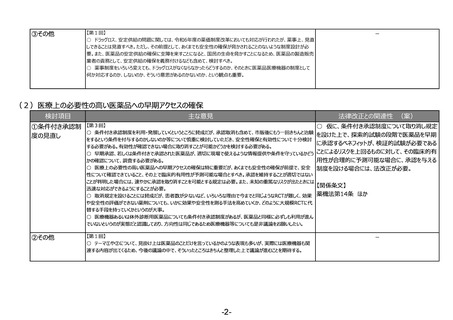
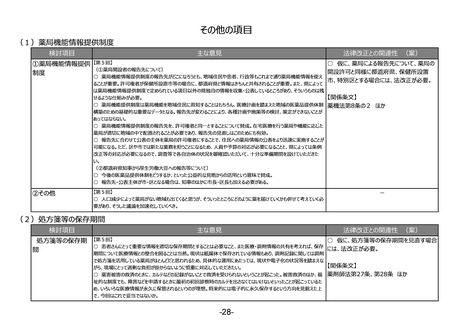
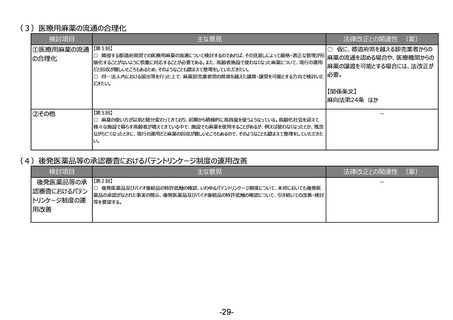
③その他
-
【第2回】
○ プログラム医療機器の登場やインターネットの普及に伴い、医療機器を使う使用者の裾野が拡大し、また、インター
ネット上では誰でも様々な情報にアクセスできるようになっていることから、医療機器に関するヘルスリテラシーの向上のため
にも一般消費者向けの広告に関し、原則として解禁すべき。(再掲)
○ 新しい医療機器として上市された場合、それが1品目しかなければ、例えば販売名を提示しないで疾患啓発という概
念で情報を提供していくが、1品目しかなければ、それが医療機器として特定されてしまうから広告と見なされてしまう。そ
のために、新しい分野でのビジネス展開もできないという事態も品目によっては発生している。このような状況を解消させる
ためにも、原則、一般消費者向けの広告を解禁として、必要な品目においては制限をかけるという逆の発想をしていくべ
き。(再掲)
○ 治療薬及びその用量調整等の選択に用いる等の医療情報の提供や、予後・リスク評価など多様化した用途で広く
医療で利用されていることから、専ら疾病の診断とされている体外診断用医薬品の定義を見直していただきたい。また、
国際整合及び現状のQMS省令に基づく管理を踏まえ、医薬品から独立させていただきたい。
○ 臨床検査に活用されているにもかかわらず、現在、体外診断用医薬品の対象外とされている製品のうち、検査性能
や結果に直接関与・影響するような一部の試薬については体外診断用医薬品の範囲に含め、適切な製造・品質管理
がなされた製品の開発・供給が可能となること、また、薬機法で求めている表示についても体外診の特性に合ったものに
見直し、適性化いただくことを要望する。
○ 現在、体外診断用医薬品が医薬品であることから毒劇薬として規制されている点については、使用現場における影
響が生じず、かつ適正な管理が継続可能と考えられることから、医薬品から独立した後も継続して毒劇薬と同様の規制
等を継続いただけることを要望する。
○ 販売業については、体外診断用医薬品の購入者に対し、情報提供を行う必要があることから、現状のとおり医薬品
と同様の取扱いを維持していただきたい。ただし、体外診断用医薬品のみを扱う販売業を新設し、その営業所管理につ
いては薬剤師以外の要件も認めていただきたい。
○ 診療用途として使用されている研究用試薬や郵送検査サービスについては、品質、有効性、及び安全性が担保さ
れるような仕組みを検討していただきたい。
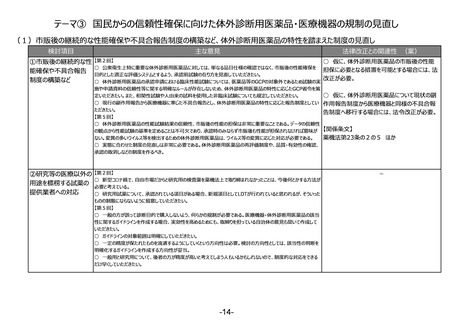
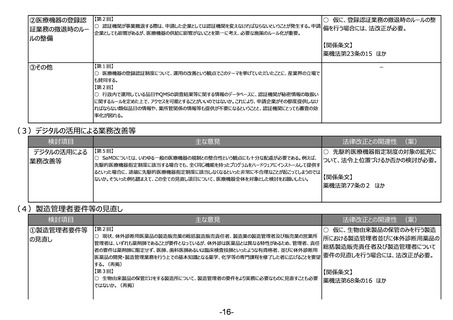
(2)医療機器の登録認証業務の撤退時のルールの整備など、登録認証制度の安定的な運用に向けた制度の見直し
検討項目
主な意見
法律改正との関連性 (案)
○ 現在、製造販売業者の同意が得られた場合
①登録認証機関が行う 【第5回】
○ 企業の立場で見ると、PMDAが立ち会うことによって調査そのものに影響があるといった感触を持つこともあるのではな
にのみ実施している登録認証機関が行う実地調
実地調査へのPMDAの
いか。PMDAが登録認証機関に対する立会検査をするという位置付けを法令上明確にする場合には、企業に対する調
査へのPMDAの同行(立会検査)について、法
同行(立会検査)の 査に影響を与えることを目的としているわけではないことも明確にしてほしい。
令上位置づけるか否かの検討が必要。
法令上の明確化
【関係条文】
薬機法第23条の6 ほか
-15-
-
【第2回】
○ プログラム医療機器の登場やインターネットの普及に伴い、医療機器を使う使用者の裾野が拡大し、また、インター
ネット上では誰でも様々な情報にアクセスできるようになっていることから、医療機器に関するヘルスリテラシーの向上のため
にも一般消費者向けの広告に関し、原則として解禁すべき。(再掲)
○ 新しい医療機器として上市された場合、それが1品目しかなければ、例えば販売名を提示しないで疾患啓発という概
念で情報を提供していくが、1品目しかなければ、それが医療機器として特定されてしまうから広告と見なされてしまう。そ
のために、新しい分野でのビジネス展開もできないという事態も品目によっては発生している。このような状況を解消させる
ためにも、原則、一般消費者向けの広告を解禁として、必要な品目においては制限をかけるという逆の発想をしていくべ
き。(再掲)
○ 治療薬及びその用量調整等の選択に用いる等の医療情報の提供や、予後・リスク評価など多様化した用途で広く
医療で利用されていることから、専ら疾病の診断とされている体外診断用医薬品の定義を見直していただきたい。また、
国際整合及び現状のQMS省令に基づく管理を踏まえ、医薬品から独立させていただきたい。
○ 臨床検査に活用されているにもかかわらず、現在、体外診断用医薬品の対象外とされている製品のうち、検査性能
や結果に直接関与・影響するような一部の試薬については体外診断用医薬品の範囲に含め、適切な製造・品質管理
がなされた製品の開発・供給が可能となること、また、薬機法で求めている表示についても体外診の特性に合ったものに
見直し、適性化いただくことを要望する。
○ 現在、体外診断用医薬品が医薬品であることから毒劇薬として規制されている点については、使用現場における影
響が生じず、かつ適正な管理が継続可能と考えられることから、医薬品から独立した後も継続して毒劇薬と同様の規制
等を継続いただけることを要望する。
○ 販売業については、体外診断用医薬品の購入者に対し、情報提供を行う必要があることから、現状のとおり医薬品
と同様の取扱いを維持していただきたい。ただし、体外診断用医薬品のみを扱う販売業を新設し、その営業所管理につ
いては薬剤師以外の要件も認めていただきたい。
○ 診療用途として使用されている研究用試薬や郵送検査サービスについては、品質、有効性、及び安全性が担保さ
れるような仕組みを検討していただきたい。
(2)医療機器の登録認証業務の撤退時のルールの整備など、登録認証制度の安定的な運用に向けた制度の見直し
検討項目
主な意見
法律改正との関連性 (案)
○ 現在、製造販売業者の同意が得られた場合
①登録認証機関が行う 【第5回】
○ 企業の立場で見ると、PMDAが立ち会うことによって調査そのものに影響があるといった感触を持つこともあるのではな
にのみ実施している登録認証機関が行う実地調
実地調査へのPMDAの
いか。PMDAが登録認証機関に対する立会検査をするという位置付けを法令上明確にする場合には、企業に対する調
査へのPMDAの同行(立会検査)について、法
同行(立会検査)の 査に影響を与えることを目的としているわけではないことも明確にしてほしい。
令上位置づけるか否かの検討が必要。
法令上の明確化
【関係条文】
薬機法第23条の6 ほか
-15-