よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
2.4 非臨床の概括評価
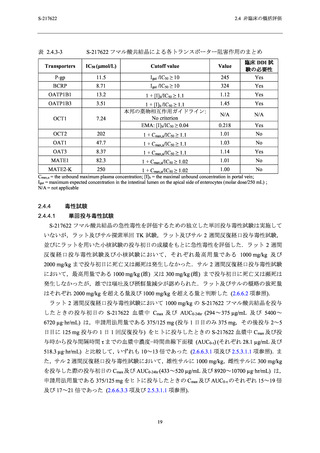
表 2.4.3-3
S-217622 フマル酸共結晶による各トランスポーター阻害作用のまとめ
Transporters
IC50 (μmol/L)
Cutoff value
Value
P-gp
11.5
Igut /IC50 ≥ 10
245
臨床 DDI 試
験の必要性
Yes
BCRP
8.71
Igut /IC50 ≥ 10
324
Yes
OATP1B1
13.2
1 + [I]h/IC50 ≥ 1.1
1.12
Yes
OATP1B3
3.51
1.45
Yes
OCT1
7.24
1 + [I]h /IC50 ≥ 1.1
本邦の薬物相互作用ガイドライン:
No criterion
EMA: [I]h/IC50 ≥ 0.04
N/A
N/A
0.218
Yes
OCT2
202
1 + Cmax,u/IC50 ≥ 1.1
1.01
No
OAT1
47.7
1 + Cmax,u/IC50 ≥ 1.1
1.03
No
OAT3
8.37
1 + Cmax,u/IC50 ≥ 1.1
1.14
Yes
MATE1
82.3
1 + Cmax,u/IC50 ≥ 1.02
1.01
No
MATE2-K
250
1 + Cmax,u/IC50 ≥ 1.02
1.00
No
Cmax,u = the unbound maximum plasma concentration; [I] h = the maximal unbound concentration in portal vein;
Igut = maximum expected concentration in the intestinal lumen on the apical side of enterocytes (molar dose/250 mL) ;
N/A = not applicable
2.4.4
2.4.4.1
毒性試験
単回投与毒性試験
S-217622 フマル酸共結晶の急性毒性を評価するための独立した単回投与毒性試験は実施して
いないが,ラット及びサル探索単回 TK 試験,ラット及びサル 2 週間反復経口投与毒性試験,
並びにラットを用いた小核試験の投与初日の成績をもとに急性毒性を評価した.ラット 2 週間
反復経口投与毒性試験及び小核試験において,それぞれ最高用量である 1000 mg/kg 及び
2000 mg/kg まで投与初日に死亡又は瀕死は発生しなかった.サル 2 週間反復経口投与毒性試験
において,最高用量である 1000 mg/kg (雄) 又は 300 mg/kg (雌) まで投与初日に死亡又は瀕死は
発生しなかったが,雄では嘔吐及び摂餌量減少が認められた.ラット及びサルの概略の致死量
はそれぞれ 2000 mg/kg を超える量及び 1000 mg/kg を超える量と判断した (2.6.6.2 項参照).
ラット 2 週間反復経口投与毒性試験において 1000 mg/kg の S-217622 フマル酸共結晶を投与
したときの投与初日の S-217622 血漿中 Cmax 及び AUC0-24hr (294~375 µg/mL 及び 5400~
6720 µg·hr/mL) は,申請用法用量である 375/125 mg (投与 1 日目のみ 375 mg,その後投与 2~5
日目に 125 mg 投与の 1 日 1 回反復投与) をヒトに投与したときの S-217622 血漿中 Cmax 及び投
与時から投与間隔時間 τ までの血漿中濃度−時間曲線下面積 (AUC0-τ) (それぞれ 28.1 µg/mL 及び
518.3 µg·hr/mL) と比較して,いずれも 10~13 倍であった (2.6.6.3.1 項及び 2.5.3.1.1 項参照).ま
た,サル 2 週間反復経口投与毒性試験において,雄性サルに 1000 mg/kg,雌性サルに 300 mg/kg
を投与した際の投与初日の Cmax 及び AUC0-24hr (433~520 µg/mL 及び 8920~10700 µg·hr/mL) は,
申請用法用量である 375/125 mg をヒトに投与したときの Cmax 及び AUC0-τ のそれぞれ 15~19 倍
及び 17~21 倍であった (2.6.6.3.3 項及び 2.5.3.1.1 項参照).
19
2.4 非臨床の概括評価
表 2.4.3-3
S-217622 フマル酸共結晶による各トランスポーター阻害作用のまとめ
Transporters
IC50 (μmol/L)
Cutoff value
Value
P-gp
11.5
Igut /IC50 ≥ 10
245
臨床 DDI 試
験の必要性
Yes
BCRP
8.71
Igut /IC50 ≥ 10
324
Yes
OATP1B1
13.2
1 + [I]h/IC50 ≥ 1.1
1.12
Yes
OATP1B3
3.51
1.45
Yes
OCT1
7.24
1 + [I]h /IC50 ≥ 1.1
本邦の薬物相互作用ガイドライン:
No criterion
EMA: [I]h/IC50 ≥ 0.04
N/A
N/A
0.218
Yes
OCT2
202
1 + Cmax,u/IC50 ≥ 1.1
1.01
No
OAT1
47.7
1 + Cmax,u/IC50 ≥ 1.1
1.03
No
OAT3
8.37
1 + Cmax,u/IC50 ≥ 1.1
1.14
Yes
MATE1
82.3
1 + Cmax,u/IC50 ≥ 1.02
1.01
No
MATE2-K
250
1 + Cmax,u/IC50 ≥ 1.02
1.00
No
Cmax,u = the unbound maximum plasma concentration; [I] h = the maximal unbound concentration in portal vein;
Igut = maximum expected concentration in the intestinal lumen on the apical side of enterocytes (molar dose/250 mL) ;
N/A = not applicable
2.4.4
2.4.4.1
毒性試験
単回投与毒性試験
S-217622 フマル酸共結晶の急性毒性を評価するための独立した単回投与毒性試験は実施して
いないが,ラット及びサル探索単回 TK 試験,ラット及びサル 2 週間反復経口投与毒性試験,
並びにラットを用いた小核試験の投与初日の成績をもとに急性毒性を評価した.ラット 2 週間
反復経口投与毒性試験及び小核試験において,それぞれ最高用量である 1000 mg/kg 及び
2000 mg/kg まで投与初日に死亡又は瀕死は発生しなかった.サル 2 週間反復経口投与毒性試験
において,最高用量である 1000 mg/kg (雄) 又は 300 mg/kg (雌) まで投与初日に死亡又は瀕死は
発生しなかったが,雄では嘔吐及び摂餌量減少が認められた.ラット及びサルの概略の致死量
はそれぞれ 2000 mg/kg を超える量及び 1000 mg/kg を超える量と判断した (2.6.6.2 項参照).
ラット 2 週間反復経口投与毒性試験において 1000 mg/kg の S-217622 フマル酸共結晶を投与
したときの投与初日の S-217622 血漿中 Cmax 及び AUC0-24hr (294~375 µg/mL 及び 5400~
6720 µg·hr/mL) は,申請用法用量である 375/125 mg (投与 1 日目のみ 375 mg,その後投与 2~5
日目に 125 mg 投与の 1 日 1 回反復投与) をヒトに投与したときの S-217622 血漿中 Cmax 及び投
与時から投与間隔時間 τ までの血漿中濃度−時間曲線下面積 (AUC0-τ) (それぞれ 28.1 µg/mL 及び
518.3 µg·hr/mL) と比較して,いずれも 10~13 倍であった (2.6.6.3.1 項及び 2.5.3.1.1 項参照).ま
た,サル 2 週間反復経口投与毒性試験において,雄性サルに 1000 mg/kg,雌性サルに 300 mg/kg
を投与した際の投与初日の Cmax 及び AUC0-24hr (433~520 µg/mL 及び 8920~10700 µg·hr/mL) は,
申請用法用量である 375/125 mg をヒトに投与したときの Cmax 及び AUC0-τ のそれぞれ 15~19 倍
及び 17~21 倍であった (2.6.6.3.3 項及び 2.5.3.1.1 項参照).
19