よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
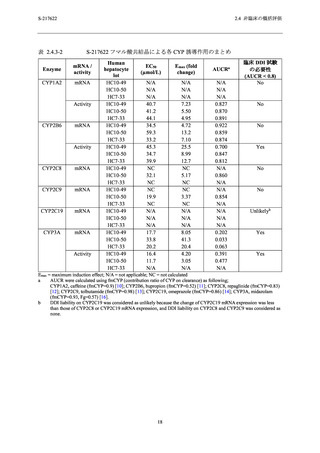
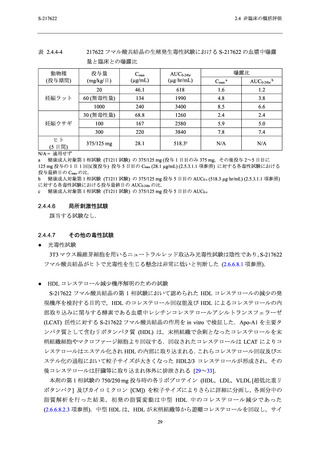
表 2.4.4-2
2.4 非臨床の概括評価
S-217622 フマル酸共結晶の反復経口投与毒性試験における無毒性量と
S-217622 の血漿中曝露量及び臨床との曝露比
動物種
(投与期間)
投与量
(mg/kg/日)
ラット
(2 週間)
1000
ラット
(4 週間)
1000
サル
(2 週間)
10
サル
(4 週間)
10
ヒト
(5 日間)
375/125 mg
性別
Cmax
(µg/mL)
AUC0-24hr
(µg·hr/mL)
雄
雌
雄
雌
雄
雌
雄
雌
269
319
263
359
77.6
75.2
76.8
95.9
3850
3940
4270
5380
1220
1170
1170
1850
Cmax
9.6
11
9.4
13
2.8
2.7
2.7
3.4
女性
28.1
518.3c
N/A
a
曝露比
AUC0-24hr b
7.4
7.6
8.2
10
2.4
2.3
2.3
3.6
N/A
N/A = 適用せず
a
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg (投与 1 日目のみ 375 mg,その後投与 2~5 日目に
125 mg 投与の 1 日 1 回反復投与) 投与 5 日目の Cmax (28.1 µg/mL) (2.5.3.1.1 項参照) に対する各毒性試験における
投与最終日の Cmax の比.
b
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg 投与 5 日目の AUC0-τ (518.3 µg·hr/mL) (2.5.3.1.1 項参照)
に対する各毒性試験における投与最終日の AUC0-24hr の比.
c
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg 投与 5 日目の AUC0-τ
2.4.4.3
遺伝毒性試験
S-217622 フマル酸共結晶の細菌を用いる復帰突然変異試験,ほ乳類の培養細胞を用いる小核
試験及びラットを用いる小核試験は陰性であり,S-217622 フマル酸共結晶の遺伝毒性リスクは
ないと判断した (2.6.6.4 項参照).
2.4.4.4
がん原性試験
S-217622 フマル酸共結晶は臨床での使用期間が最大で 5 日間と短いこと及び実施した遺伝毒
性試験の結果が全て陰性であったことより (2.6.6.4 項参照),がん原性の懸念は低いと判断し,
がん原性試験は実施しなかった.
2.4.4.5
生殖発生毒性試験
生殖発生毒性試験で認められた主な毒性所見及び無毒性量を表 2.4.4-3,各試験における血漿
中曝露量 (Cmax 及び AUC0-24hr) 並びに申請用法用量における血漿中曝露量 (Cmax 及び AUC0-τ)
との比を表 2.4.4-4 に示す.
ラット受胎能及び初期胚発生に関する試験 (投与量:20,60 及び 1000 mg/kg/日) では,
1000 mg/kg/日までの用量で,雌雄の一般状態,交尾能及び受胎能,並びに初期胚発生に対して
影響は認められなかった (2.6.6.6.1 項参照).また,ラット胚・胎児発生に関する試験 (投与量:
20,60 及び 1000 mg/kg/日) では,1000 mg/kg/日まで胚・胎児の形態異常及び致死は認められず,
母動物の生殖機能に影響は認められなかった.1000 mg/kg/日投与群において,母動物で投与期
間を通じた体重増加抑制及び投与初期における摂餌量減少が認められた.胚・胎児では
26
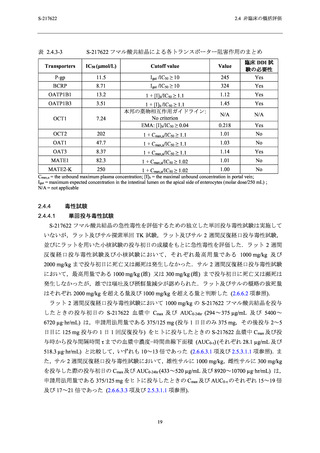
表 2.4.4-2
2.4 非臨床の概括評価
S-217622 フマル酸共結晶の反復経口投与毒性試験における無毒性量と
S-217622 の血漿中曝露量及び臨床との曝露比
動物種
(投与期間)
投与量
(mg/kg/日)
ラット
(2 週間)
1000
ラット
(4 週間)
1000
サル
(2 週間)
10
サル
(4 週間)
10
ヒト
(5 日間)
375/125 mg
性別
Cmax
(µg/mL)
AUC0-24hr
(µg·hr/mL)
雄
雌
雄
雌
雄
雌
雄
雌
269
319
263
359
77.6
75.2
76.8
95.9
3850
3940
4270
5380
1220
1170
1170
1850
Cmax
9.6
11
9.4
13
2.8
2.7
2.7
3.4
女性
28.1
518.3c
N/A
a
曝露比
AUC0-24hr b
7.4
7.6
8.2
10
2.4
2.3
2.3
3.6
N/A
N/A = 適用せず
a
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg (投与 1 日目のみ 375 mg,その後投与 2~5 日目に
125 mg 投与の 1 日 1 回反復投与) 投与 5 日目の Cmax (28.1 µg/mL) (2.5.3.1.1 項参照) に対する各毒性試験における
投与最終日の Cmax の比.
b
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg 投与 5 日目の AUC0-τ (518.3 µg·hr/mL) (2.5.3.1.1 項参照)
に対する各毒性試験における投与最終日の AUC0-24hr の比.
c
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg 投与 5 日目の AUC0-τ
2.4.4.3
遺伝毒性試験
S-217622 フマル酸共結晶の細菌を用いる復帰突然変異試験,ほ乳類の培養細胞を用いる小核
試験及びラットを用いる小核試験は陰性であり,S-217622 フマル酸共結晶の遺伝毒性リスクは
ないと判断した (2.6.6.4 項参照).
2.4.4.4
がん原性試験
S-217622 フマル酸共結晶は臨床での使用期間が最大で 5 日間と短いこと及び実施した遺伝毒
性試験の結果が全て陰性であったことより (2.6.6.4 項参照),がん原性の懸念は低いと判断し,
がん原性試験は実施しなかった.
2.4.4.5
生殖発生毒性試験
生殖発生毒性試験で認められた主な毒性所見及び無毒性量を表 2.4.4-3,各試験における血漿
中曝露量 (Cmax 及び AUC0-24hr) 並びに申請用法用量における血漿中曝露量 (Cmax 及び AUC0-τ)
との比を表 2.4.4-4 に示す.
ラット受胎能及び初期胚発生に関する試験 (投与量:20,60 及び 1000 mg/kg/日) では,
1000 mg/kg/日までの用量で,雌雄の一般状態,交尾能及び受胎能,並びに初期胚発生に対して
影響は認められなかった (2.6.6.6.1 項参照).また,ラット胚・胎児発生に関する試験 (投与量:
20,60 及び 1000 mg/kg/日) では,1000 mg/kg/日まで胚・胎児の形態異常及び致死は認められず,
母動物の生殖機能に影響は認められなかった.1000 mg/kg/日投与群において,母動物で投与期
間を通じた体重増加抑制及び投与初期における摂餌量減少が認められた.胚・胎児では
26