よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
●
2.4 非臨床の概括評価
嘔吐
サル 2 週間反復経口投与毒性試験の 1000/300/100 mg/kg/日投与群の雄及び 300/100 mg/kg/日
投与群の雌において,嘔吐が認められた.雌雄共に嘔吐の発現頻度は投与期間前半の方が高く,
投与量減少に伴い発現頻度は低下する傾向にあった.また,2 週間の休薬期間中に嘔吐は認めら
れなかった (2.6.6.3.3 項参照).
嘔吐は,嘔吐中枢を刺激する原因によって中枢性と末梢性に大別され,中枢性の原因の一つ
として,
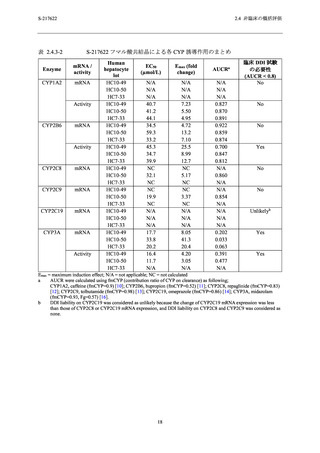
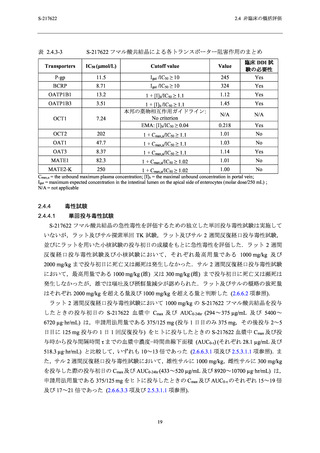
サルを含む複数の動物種で非選択的な PDE4 阻害による嘔吐作用が報告されている [19
~22].本剤の副次的薬理評価では,PDE4A1A,PDE4B1,PDE4C1 及び PDE4D2 の阻害作用 (IC50
= 63.2~75.7 µmol/L) が確認された (2.6.2.3.1 項参照).サル 2 週間反復経口投与毒性試験におい
て嘔吐が認められた 1000/300/100 mg/kg/日投与群の雄及び 300/100 mg/kg/日投与群の雌の非結
合型 Cmax は 14~17 µmol/L (総薬物濃度 [433~520 µg/mL],分子量 [531.88] 及びサル血漿中タ
ンパク結合率 [98.3%] を基に算出) であり (2.6.6.3.3 項及び 2.6.4.4.1.1 項参照),各種 PDE4 阻
害の IC50 値との乖離は 3.7~5.4 倍であった.前述した通り,サルの高用量群では S-217622 フマ
ル酸共結晶とアルブミン結合の飽和が起こり,非結合型の血漿中 S-217622 濃度が増加した可能
性がある.これらを考慮すると,サル 2 週間反復経口投与毒性試験の高用量群で認められた嘔
吐は,非特異的 PDE4 阻害に起因している可能性がある.ヒトにおいては,PDE4 の IC50 値 (63.2
~75.7 µmol/L) が,申請用法用量における非結合型 Cmax (1.2 µmol/L;総薬物濃度 [28.1 µg/mL],
分子量 [531.88] 及びヒト血漿中タンパク結合率 [97.7%] から算出) (2.5.3.1.1 項及び 2.6.4.4.1.1
項参照) に対して 53~63 倍乖離していることから,申請用法用量において非選択的 PDE4 阻害
により嘔吐が起こる懸念は低いと考えられる (2.6.2.6.2 項参照).
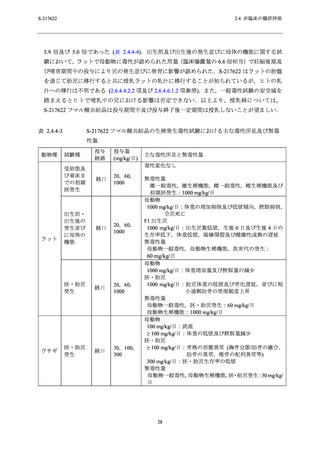
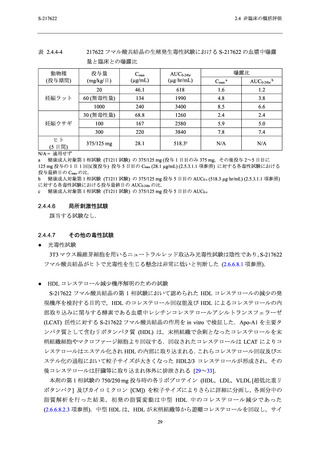
申請用法用量におけるヒト曝露量は,サル 4 週間反復経口投与毒性試験の無毒性量における
曝露量の範囲内 (Cmax:2.7~3.4 倍及び AUC:2.3~3.6 倍) にあり (表 2.4.4-2),本剤の第 1 相
及び第 2/3 相試験において嘔吐,悪心が発現したものの,重篤なものはなかった (2.5.5.2 項参
照).以上のことから,申請用法用量において嘔吐や悪心が発現する可能性はあるが,嘔吐や悪
心が更なる有害事象に繋がる懸念は低いと考えられる.
●
摂餌量の減少
サル 2 週間反復経口投与毒性試験の 50 mg/kg/日以上の投与群及び 4 週間反復経口投与毒性試
験の 30 mg/kg/日投与群において摂餌量減少が認められた.いずれの試験においても消化管への
器質的変化は認められず,その機序は不明であった.サル 4 週間反復経口投与毒性試験の
30 mg/kg/日投与群で認められた摂餌量減少は投与 10日目以降に発現した.摂餌量減少は,休薬
により回復した (2.6.6.3.3 項及び 2.6.6.3.4 項参照).申請用法用量におけるヒト曝露量は,サル
4 週間反復経口投与毒性試験の無毒性量における曝露量の範囲内 (Cmax :2.7~3.4 倍及び
AUC0-24hr:2.3~3.6 倍) にあること (表 2.4.4-2),S-217622 フマル酸共結晶の臨床予定投与期間
は 5日間と短期であること,本剤の第 1 相及び第 2/3 相試験では,食欲低下やそれに関連する有
害事象は現時点では認められていない (2.5.5.2 項参照) ことから,申請用法用量では,食欲低下
やそれに関連した有害事象が起こる可能性は低いと考えられる.
22
●
2.4 非臨床の概括評価
嘔吐
サル 2 週間反復経口投与毒性試験の 1000/300/100 mg/kg/日投与群の雄及び 300/100 mg/kg/日
投与群の雌において,嘔吐が認められた.雌雄共に嘔吐の発現頻度は投与期間前半の方が高く,
投与量減少に伴い発現頻度は低下する傾向にあった.また,2 週間の休薬期間中に嘔吐は認めら
れなかった (2.6.6.3.3 項参照).
嘔吐は,嘔吐中枢を刺激する原因によって中枢性と末梢性に大別され,中枢性の原因の一つ
として,
サルを含む複数の動物種で非選択的な PDE4 阻害による嘔吐作用が報告されている [19
~22].本剤の副次的薬理評価では,PDE4A1A,PDE4B1,PDE4C1 及び PDE4D2 の阻害作用 (IC50
= 63.2~75.7 µmol/L) が確認された (2.6.2.3.1 項参照).サル 2 週間反復経口投与毒性試験におい
て嘔吐が認められた 1000/300/100 mg/kg/日投与群の雄及び 300/100 mg/kg/日投与群の雌の非結
合型 Cmax は 14~17 µmol/L (総薬物濃度 [433~520 µg/mL],分子量 [531.88] 及びサル血漿中タ
ンパク結合率 [98.3%] を基に算出) であり (2.6.6.3.3 項及び 2.6.4.4.1.1 項参照),各種 PDE4 阻
害の IC50 値との乖離は 3.7~5.4 倍であった.前述した通り,サルの高用量群では S-217622 フマ
ル酸共結晶とアルブミン結合の飽和が起こり,非結合型の血漿中 S-217622 濃度が増加した可能
性がある.これらを考慮すると,サル 2 週間反復経口投与毒性試験の高用量群で認められた嘔
吐は,非特異的 PDE4 阻害に起因している可能性がある.ヒトにおいては,PDE4 の IC50 値 (63.2
~75.7 µmol/L) が,申請用法用量における非結合型 Cmax (1.2 µmol/L;総薬物濃度 [28.1 µg/mL],
分子量 [531.88] 及びヒト血漿中タンパク結合率 [97.7%] から算出) (2.5.3.1.1 項及び 2.6.4.4.1.1
項参照) に対して 53~63 倍乖離していることから,申請用法用量において非選択的 PDE4 阻害
により嘔吐が起こる懸念は低いと考えられる (2.6.2.6.2 項参照).
申請用法用量におけるヒト曝露量は,サル 4 週間反復経口投与毒性試験の無毒性量における
曝露量の範囲内 (Cmax:2.7~3.4 倍及び AUC:2.3~3.6 倍) にあり (表 2.4.4-2),本剤の第 1 相
及び第 2/3 相試験において嘔吐,悪心が発現したものの,重篤なものはなかった (2.5.5.2 項参
照).以上のことから,申請用法用量において嘔吐や悪心が発現する可能性はあるが,嘔吐や悪
心が更なる有害事象に繋がる懸念は低いと考えられる.
●
摂餌量の減少
サル 2 週間反復経口投与毒性試験の 50 mg/kg/日以上の投与群及び 4 週間反復経口投与毒性試
験の 30 mg/kg/日投与群において摂餌量減少が認められた.いずれの試験においても消化管への
器質的変化は認められず,その機序は不明であった.サル 4 週間反復経口投与毒性試験の
30 mg/kg/日投与群で認められた摂餌量減少は投与 10日目以降に発現した.摂餌量減少は,休薬
により回復した (2.6.6.3.3 項及び 2.6.6.3.4 項参照).申請用法用量におけるヒト曝露量は,サル
4 週間反復経口投与毒性試験の無毒性量における曝露量の範囲内 (Cmax :2.7~3.4 倍及び
AUC0-24hr:2.3~3.6 倍) にあること (表 2.4.4-2),S-217622 フマル酸共結晶の臨床予定投与期間
は 5日間と短期であること,本剤の第 1 相及び第 2/3 相試験では,食欲低下やそれに関連する有
害事象は現時点では認められていない (2.5.5.2 項参照) ことから,申請用法用量では,食欲低下
やそれに関連した有害事象が起こる可能性は低いと考えられる.
22