よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
2.4.4.2
2.4 非臨床の概括評価
反復投与毒性試験
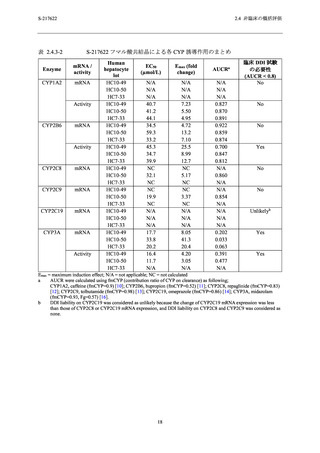
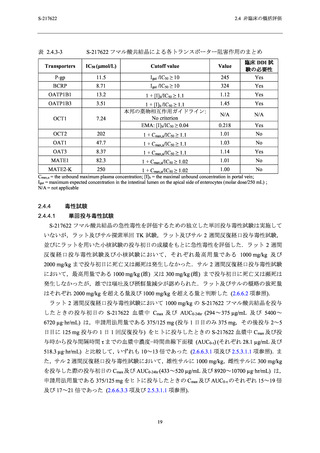
ラット及びサル反復経口投与毒性試験で認められた所見の概要を表 2.4.4-1,各試験の無毒性
量における血漿中曝露量 (Cmax 及び AUC0-24hr) 並びに申請用法用量における血漿中曝露量
(Cmax 及び AUC0-τ) との比を表 2.4.4-2 に示す.
ラット 2 週間 (投与量:20,100 及び 1000 mg/kg/日) 及び 4 週間反復経口投与毒性試験 (投与
量:20,50 及び 1000 mg/kg/日) では,1000 mg/kg/日投与群まで毒性変化は認められず,無毒性
量はいずれの試験も 1000 mg/kg/日と判断した (表 2.4.4-1).ラット 4 週間反復経口投与毒性試
験の無毒性量 (1000 mg/kg/日) における S-217622 の血漿中曝露量 (Cmax 及び AUC0-24hr) は,申
請用法用量である 375/125 mg をヒトに投与したときの Cmax 及び AUC0-τ (28.1 µg/mL 及び
518.3 µg·hr/mL) と比較して,それぞれ 9~13 倍及び 8~10 倍であり,十分な乖離があった (表
2.4.4-2).
サル 2 週間 (雄投与量:10,50 及び 1000/300/100 mg/kg/日 [投与 3 日目に 1000 mg/kg/日から
300 mg/kg/日,投与 8 日目に 300 mg/kg/日から 100 mg/kg/日に減量],雌投与量:10,50 及び
300/100 mg/kg/日 [投与 9 日目に 300 mg/kg/日から 100 mg/kg/日に減量]) 及び 4 週間反復経口投
与毒性試験 (投与量:3,10 及び 30 mg/kg/日) で認められた毒性所見は,死亡/瀕死,嘔吐,摂
餌量減少を伴う体重減少,赤血球系パラメータ及び血小板の減少並びに血中炎症性マーカーの
変動を伴う多臓器における炎症性変化であった (表 2.4.4-1).サル 4 週間反復経口投与毒性試験
の無毒性量 (10 mg/kg/日) における S-217622 の血漿中曝露量 (Cmax 及び AUC0-24hr) は,申請用
法用量の Cmax 及び AUC0-τ (28.1 µg/mL 及び 518.3 µg·hr/mL) と比較して,それぞれ 2.7~3.4 倍及
び 2.3~3.6 倍であった (表 2.4.4-2).
サル 2 週間反復経口投与毒性試験では,1000 mg/kg/日の用量又は 1000 mg/kg/日から
300 mg/kg/日に減量して投与した雄,並びに 300 mg/kg/日の用量を投与した雌の一部の個体に死
亡 / 瀕 死 例 が 発 生 し た (2.6.6.3.3 項 参 照 ) . ま た , サ ル 2 週 間 反 復 経 口 投 与 毒 性 試 験 の
1000/300/100 mg/kg/日 (雄),300/100 mg/kg/日 (雌),及びサル 4 週間反復経口投与毒性試験の
30 mg/kg/日の用量で継続的な摂餌量減少による獣医学的ケアを必要とする動物が発生した
(2.6.6.3.3 項及び 2.6.6.3.4 項参照).これらの個体では,摂餌量の減少及び炎症性変化に起因する
と考えられる低アルブミン血症 (2.2~3.0 g/dL [333~455 µmol/L]) を呈していた.S-217622 の血
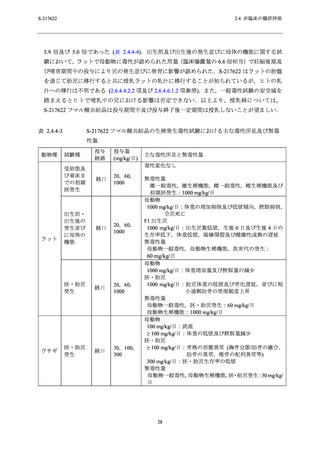
清中主要結合タンパクはアルブミン (2.6.4.4.1.1 項参照) であり,一般的に血漿中薬物モル濃度
が血漿中アルブミンのモル濃度を超えた場合に,アルブミン結合が飽和し,血中非結合型薬物
濃度が急激に増加することが知られている [17].重篤な毒性が認められた個体の投与終了日の
Cmax は 211 µg/mL (397 µmol/L) 以上であり,血漿中アルブミンのモル濃度と同等又は超えてい
たことから,これら個体では非結合型の血漿中 S-217622 濃度の増加に伴い,毒性が強く発現し
た可能性が考えられた.
S-217622 フマル酸共結晶に起因するその他の主な所見として,サルでは間接ビリルビン
(I.Bil) の増加を主体とする総ビリルビンの増加,並びに HDL 及び低比重リポタンパク (LDL)
コレステロールの減少が認められたが,いずれの変化も関連する病理組織学的変化を伴ってい
なかったため,毒性ではないと判断した (2.6.6.3.3 項及び 2.6.6.3.4 項参照).サルで認められた
20
2.4.4.2
2.4 非臨床の概括評価
反復投与毒性試験
ラット及びサル反復経口投与毒性試験で認められた所見の概要を表 2.4.4-1,各試験の無毒性
量における血漿中曝露量 (Cmax 及び AUC0-24hr) 並びに申請用法用量における血漿中曝露量
(Cmax 及び AUC0-τ) との比を表 2.4.4-2 に示す.
ラット 2 週間 (投与量:20,100 及び 1000 mg/kg/日) 及び 4 週間反復経口投与毒性試験 (投与
量:20,50 及び 1000 mg/kg/日) では,1000 mg/kg/日投与群まで毒性変化は認められず,無毒性
量はいずれの試験も 1000 mg/kg/日と判断した (表 2.4.4-1).ラット 4 週間反復経口投与毒性試
験の無毒性量 (1000 mg/kg/日) における S-217622 の血漿中曝露量 (Cmax 及び AUC0-24hr) は,申
請用法用量である 375/125 mg をヒトに投与したときの Cmax 及び AUC0-τ (28.1 µg/mL 及び
518.3 µg·hr/mL) と比較して,それぞれ 9~13 倍及び 8~10 倍であり,十分な乖離があった (表
2.4.4-2).
サル 2 週間 (雄投与量:10,50 及び 1000/300/100 mg/kg/日 [投与 3 日目に 1000 mg/kg/日から
300 mg/kg/日,投与 8 日目に 300 mg/kg/日から 100 mg/kg/日に減量],雌投与量:10,50 及び
300/100 mg/kg/日 [投与 9 日目に 300 mg/kg/日から 100 mg/kg/日に減量]) 及び 4 週間反復経口投
与毒性試験 (投与量:3,10 及び 30 mg/kg/日) で認められた毒性所見は,死亡/瀕死,嘔吐,摂
餌量減少を伴う体重減少,赤血球系パラメータ及び血小板の減少並びに血中炎症性マーカーの
変動を伴う多臓器における炎症性変化であった (表 2.4.4-1).サル 4 週間反復経口投与毒性試験
の無毒性量 (10 mg/kg/日) における S-217622 の血漿中曝露量 (Cmax 及び AUC0-24hr) は,申請用
法用量の Cmax 及び AUC0-τ (28.1 µg/mL 及び 518.3 µg·hr/mL) と比較して,それぞれ 2.7~3.4 倍及
び 2.3~3.6 倍であった (表 2.4.4-2).
サル 2 週間反復経口投与毒性試験では,1000 mg/kg/日の用量又は 1000 mg/kg/日から
300 mg/kg/日に減量して投与した雄,並びに 300 mg/kg/日の用量を投与した雌の一部の個体に死
亡 / 瀕 死 例 が 発 生 し た (2.6.6.3.3 項 参 照 ) . ま た , サ ル 2 週 間 反 復 経 口 投 与 毒 性 試 験 の
1000/300/100 mg/kg/日 (雄),300/100 mg/kg/日 (雌),及びサル 4 週間反復経口投与毒性試験の
30 mg/kg/日の用量で継続的な摂餌量減少による獣医学的ケアを必要とする動物が発生した
(2.6.6.3.3 項及び 2.6.6.3.4 項参照).これらの個体では,摂餌量の減少及び炎症性変化に起因する
と考えられる低アルブミン血症 (2.2~3.0 g/dL [333~455 µmol/L]) を呈していた.S-217622 の血
清中主要結合タンパクはアルブミン (2.6.4.4.1.1 項参照) であり,一般的に血漿中薬物モル濃度
が血漿中アルブミンのモル濃度を超えた場合に,アルブミン結合が飽和し,血中非結合型薬物
濃度が急激に増加することが知られている [17].重篤な毒性が認められた個体の投与終了日の
Cmax は 211 µg/mL (397 µmol/L) 以上であり,血漿中アルブミンのモル濃度と同等又は超えてい
たことから,これら個体では非結合型の血漿中 S-217622 濃度の増加に伴い,毒性が強く発現し
た可能性が考えられた.
S-217622 フマル酸共結晶に起因するその他の主な所見として,サルでは間接ビリルビン
(I.Bil) の増加を主体とする総ビリルビンの増加,並びに HDL 及び低比重リポタンパク (LDL)
コレステロールの減少が認められたが,いずれの変化も関連する病理組織学的変化を伴ってい
なかったため,毒性ではないと判断した (2.6.6.3.3 項及び 2.6.6.3.4 項参照).サルで認められた
20