よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
2.4 非臨床の概括評価
本剤の第 1 相試験においては,高ビリルビン血症及びビリルビン値の増加は認められていな
い (2.5.5.2 項参照).第 2/3 相試験 (T1221 試験) の Phase 2a Part では,申請用法用量である
375/125 mg 投与により高ビリルビン血症及びビリルビン値の増加は認められていないが,
750/250 mg 投与により本剤の投与に関連する高ビリルビン血症及び血中ビリルビン増加がそれ
ぞれ 1/23 例で認められた.また,Phase 2b Part では,申請用法用量である 375/125 mg 投与及び
750/250 mg 投与により本剤の投与に関連する血中ビリルビン増加がそれぞれ 1/140 例で認めら
れたが,軽度かつ一時的な変動であると考えられた (2.5.5.2 項及び 2.5.5.3 参照).
申請用法用量 (375/125 mg) における非結合型 Cmax (1.2 µmol/L) 値は OATP 阻害の IC50 値
(3.51 及び 13.2 µmol/L) よりも低値であり,OATP 阻害が起こる可能性は低く,申請用法用量で
は,OATP 阻害に起因した肝障害を引き起こす可能性は低いと考えられる.
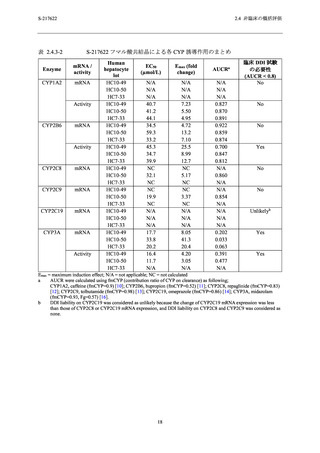
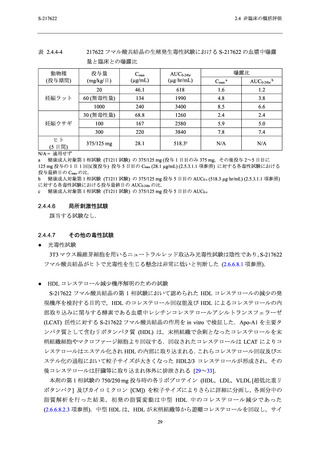
表 2.4.4-1
S-217622 フマル酸共結晶の反復経口投与毒性試験における主な毒性所見
動物種
投与期間
投与量 a (mg/kg/日)
主な毒性所見
ラット
2 週間
4 週間
20,100,1000
20,50,1000
2 週間
10,50,
[雄]1000/300/100b,
[雌]300/100c
毒性変化なし
毒性変化なし
[雄] 1000/300/100 mg/kg/日,[雌] 300/100 mg/kg/日:死亡/
瀕死及び嘔吐
≥ 50 mg/kg/日:赤血球系パラメータの減少,血中炎症性
マーカーの変動を伴う多臓器における炎症性変化,摂餌
量減少を伴う体重減少及び血小板減少
4 週間
3,10,30
サル
a
b
c
30 mg/kg/日:赤血球系パラメータの減少,摂餌量減少を
伴う体重減少,血中炎症性マーカーの変動を伴う子宮及
び胆嚢筋層における炎症性変化
下線は無毒性量を示す.
投与 3 日目の投与前に瀕死が発生したため,投与 3 日目から投与量を 1000 mg/kg/日から 300 mg/kg/日に減量
し,さらに,投与 8 日目の投与前に死亡が発生したため,投与 8 日目から投与量を 100 mg/kg/日に減量し
た.
投与 8 日目の投与後に瀕死が発生したため,投与 9 日目から投与量を 300 mg/kg/日から 100 mg/kg/日に減量
した.
25
2.4 非臨床の概括評価
本剤の第 1 相試験においては,高ビリルビン血症及びビリルビン値の増加は認められていな
い (2.5.5.2 項参照).第 2/3 相試験 (T1221 試験) の Phase 2a Part では,申請用法用量である
375/125 mg 投与により高ビリルビン血症及びビリルビン値の増加は認められていないが,
750/250 mg 投与により本剤の投与に関連する高ビリルビン血症及び血中ビリルビン増加がそれ
ぞれ 1/23 例で認められた.また,Phase 2b Part では,申請用法用量である 375/125 mg 投与及び
750/250 mg 投与により本剤の投与に関連する血中ビリルビン増加がそれぞれ 1/140 例で認めら
れたが,軽度かつ一時的な変動であると考えられた (2.5.5.2 項及び 2.5.5.3 参照).
申請用法用量 (375/125 mg) における非結合型 Cmax (1.2 µmol/L) 値は OATP 阻害の IC50 値
(3.51 及び 13.2 µmol/L) よりも低値であり,OATP 阻害が起こる可能性は低く,申請用法用量で
は,OATP 阻害に起因した肝障害を引き起こす可能性は低いと考えられる.
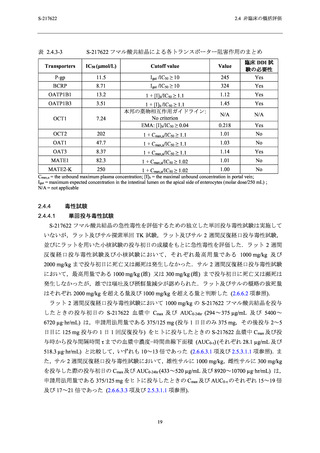
表 2.4.4-1
S-217622 フマル酸共結晶の反復経口投与毒性試験における主な毒性所見
動物種
投与期間
投与量 a (mg/kg/日)
主な毒性所見
ラット
2 週間
4 週間
20,100,1000
20,50,1000
2 週間
10,50,
[雄]1000/300/100b,
[雌]300/100c
毒性変化なし
毒性変化なし
[雄] 1000/300/100 mg/kg/日,[雌] 300/100 mg/kg/日:死亡/
瀕死及び嘔吐
≥ 50 mg/kg/日:赤血球系パラメータの減少,血中炎症性
マーカーの変動を伴う多臓器における炎症性変化,摂餌
量減少を伴う体重減少及び血小板減少
4 週間
3,10,30
サル
a
b
c
30 mg/kg/日:赤血球系パラメータの減少,摂餌量減少を
伴う体重減少,血中炎症性マーカーの変動を伴う子宮及
び胆嚢筋層における炎症性変化
下線は無毒性量を示す.
投与 3 日目の投与前に瀕死が発生したため,投与 3 日目から投与量を 1000 mg/kg/日から 300 mg/kg/日に減量
し,さらに,投与 8 日目の投与前に死亡が発生したため,投与 8 日目から投与量を 100 mg/kg/日に減量し
た.
投与 8 日目の投与後に瀕死が発生したため,投与 9 日目から投与量を 300 mg/kg/日から 100 mg/kg/日に減量
した.
25