よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
2.4 非臨床の概括評価
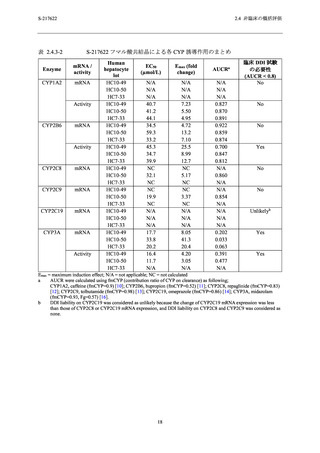
表 2.4.4-4
217622 フマル酸共結晶の生殖発生毒性試験における S-217622 の血漿中曝露
量と臨床との曝露比
動物種
(投与期間)
妊娠ラット
妊娠ウサギ
ヒト
(5 日間)
曝露比
投与量
(mg/kg/日)
Cmax
(µg/mL)
AUC0-24hr
(µg·hr/mL)
Cmax
20
46.1
618
1.6
1.2
60 (無毒性量)
134
1990
4.8
3.8
1000
240
3400
8.5
6.6
30 (無毒性量)
68.8
1260
2.4
2.4
100
167
2580
5.9
5.0
300
220
3840
7.8
7.4
375/125 mg
28.1
518.3c
N/A
N/A
a
AUC0-24hr b
N/A = 適用せず
a
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg (投与 1 日目のみ 375 mg,その後投与 2~5 日目に
125 mg 投与の 1 日 1 回反復投与) 投与 5 日目の Cmax (28.1 µg/mL) (2.5.3.1.1 項参照) に対する各毒性試験における
投与最終日の Cmax の比.
b
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg 投与 5 日目の AUC0-τ (518.3 µg·hr/mL) (2.5.3.1.1 項参照)
に対する各毒性試験における投与最終日の AUC0-24hr の比.
c
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg 投与 5 日目の AUC0-τ
2.4.4.6
局所刺激性試験
該当する試験なし.
2.4.4.7
●
その他の毒性試験
光毒性試験
3T3 マウス線維芽細胞を用いるニュートラルレッド取込み光毒性試験は陰性であり,
S-217622
フマル酸共結晶がヒトで光毒性を生じる懸念は非常に低いと判断した (2.6.6.8.1 項参照).
●
HDL コレステロール減少機序解明のための試験
S-217622 フマル酸共結晶の第 1 相試験において認められた HDL コレステロールの減少の発
現機序を検討する目的で,HDL のコレステロール回収能及び HDL によるコレステロールの内
部取り込みに関与する酵素である血漿中レシチンコレステロールアシルトランスフェラーゼ
(LCAT) 活性に対する S-217622 フマル酸共結晶の作用を in vitro で検証した.Apo-A1 を主要タ
ンパク質として含むリポタンパク質 (HDL) は,末梢組織で余剰となったコレステロールを末
梢組織細胞やマクロファージ細胞より回収する.回収されたコレステロールは LCAT によりコ
レステロールはエステル化され HDL の内部に取り込まれる.これらコレステロール回収及びエ
ステル化の過程において粒子サイズが大きくなった HDL2/3 コレステロールが形成され,その
後コレステロールは肝臓等に取り込まれ体外に排泄される [29~33].
本剤の第 1 相試験の 750/250 mg 投与時の各リポプロテイン (HDL,LDL,VLDL [超低比重リ
ポタンパク] 及びカイロミクロン [CM]) を粒子サイズによりさらに詳細に分画し,各画分中の
脂質解析を行った結果,初発の脂質変動は中型 HDL 中のコレステロール減少であった
(2.6.6.8.2.3 項参照).中型 HDL は,HDL が末梢組織等から遊離コレステロールを回収し,サイ
29
2.4 非臨床の概括評価
表 2.4.4-4
217622 フマル酸共結晶の生殖発生毒性試験における S-217622 の血漿中曝露
量と臨床との曝露比
動物種
(投与期間)
妊娠ラット
妊娠ウサギ
ヒト
(5 日間)
曝露比
投与量
(mg/kg/日)
Cmax
(µg/mL)
AUC0-24hr
(µg·hr/mL)
Cmax
20
46.1
618
1.6
1.2
60 (無毒性量)
134
1990
4.8
3.8
1000
240
3400
8.5
6.6
30 (無毒性量)
68.8
1260
2.4
2.4
100
167
2580
5.9
5.0
300
220
3840
7.8
7.4
375/125 mg
28.1
518.3c
N/A
N/A
a
AUC0-24hr b
N/A = 適用せず
a
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg (投与 1 日目のみ 375 mg,その後投与 2~5 日目に
125 mg 投与の 1 日 1 回反復投与) 投与 5 日目の Cmax (28.1 µg/mL) (2.5.3.1.1 項参照) に対する各毒性試験における
投与最終日の Cmax の比.
b
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg 投与 5 日目の AUC0-τ (518.3 µg·hr/mL) (2.5.3.1.1 項参照)
に対する各毒性試験における投与最終日の AUC0-24hr の比.
c
健康成人対象第 1 相試験 (T1211 試験) の 375/125 mg 投与 5 日目の AUC0-τ
2.4.4.6
局所刺激性試験
該当する試験なし.
2.4.4.7
●
その他の毒性試験
光毒性試験
3T3 マウス線維芽細胞を用いるニュートラルレッド取込み光毒性試験は陰性であり,
S-217622
フマル酸共結晶がヒトで光毒性を生じる懸念は非常に低いと判断した (2.6.6.8.1 項参照).
●
HDL コレステロール減少機序解明のための試験
S-217622 フマル酸共結晶の第 1 相試験において認められた HDL コレステロールの減少の発
現機序を検討する目的で,HDL のコレステロール回収能及び HDL によるコレステロールの内
部取り込みに関与する酵素である血漿中レシチンコレステロールアシルトランスフェラーゼ
(LCAT) 活性に対する S-217622 フマル酸共結晶の作用を in vitro で検証した.Apo-A1 を主要タ
ンパク質として含むリポタンパク質 (HDL) は,末梢組織で余剰となったコレステロールを末
梢組織細胞やマクロファージ細胞より回収する.回収されたコレステロールは LCAT によりコ
レステロールはエステル化され HDL の内部に取り込まれる.これらコレステロール回収及びエ
ステル化の過程において粒子サイズが大きくなった HDL2/3 コレステロールが形成され,その
後コレステロールは肝臓等に取り込まれ体外に排泄される [29~33].
本剤の第 1 相試験の 750/250 mg 投与時の各リポプロテイン (HDL,LDL,VLDL [超低比重リ
ポタンパク] 及びカイロミクロン [CM]) を粒子サイズによりさらに詳細に分画し,各画分中の
脂質解析を行った結果,初発の脂質変動は中型 HDL 中のコレステロール減少であった
(2.6.6.8.2.3 項参照).中型 HDL は,HDL が末梢組織等から遊離コレステロールを回収し,サイ
29