よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
2.4 非臨床の概括評価
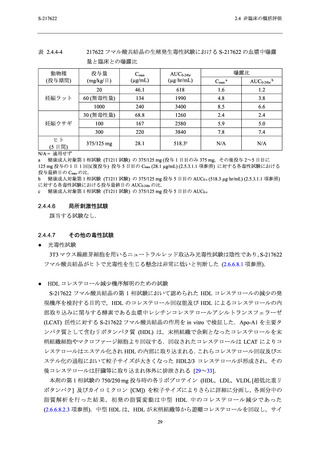
ズの大きくなった画分であると考えられる [34].また,HDL によるコレステロール回収への影
響に関する in vitro 試験を実施した結果,S-217622 が HDL によるコレステロール回収能及び
LCAT を直接的に阻害する可能性は低いと考えられた (2.6.6.8.2.1 項及び 2.6.6.8.2.2 項参照).以
上のことから,S-217622 による HDL コレステロール減少は,HDL がコレステロールを回収し
た以降の成熟過程又は排泄に影響したことに起因すると推察されたが,その機序は不明であっ
た.
本剤の第 1 相試験の 750/250 mg 投与時の脂質解析の結果,HDL コレステロール減少の他に
認められた主な変化は小型 LDL のコレステロール減少,並びに大型 LDL 及び小型 VLDL のト
リグリセリドの増加であった.HDL 中のコレステロールは,LCAT によりエステル化された後
に,コレステリルエステル転送タンパク (CETP) によって LDL 及び VLDL 分画のトリグリセ
リドと交換される [35].S-217622 の投与により中型 HDL のコレステロール減少が起こり,そ
の二次的変化として CETP による HDL コレステロールと LDL 及び VLDL のトリグリセリドの
交換が減少し,小型 LDL のコレステロール減少や,小型 VLDL 及び大型 LDL のトリグリセリ
ド増加等の変化が生じたと考えられた.S-217622 フマル酸共結晶のサル 4 週間反復経口投与毒
性試験において,投与 10 及び 27 日目に 10 mg/kg/日以上の用量で HDL 及び LDL コレステロー
ル減少が認められた.10 mg/kg/日の用量では総コレステロールの減少,並びに 30 mg/kg/日の用
量では総コレステロールの増加及びトリグリセリドの増加を伴っていた.また病理組織学的検
査では,門脈周囲における肝細胞肥大が認められた (2.6.6.3.4 項参照).サルで認められた脂質
の変動に関連する病理組織学的な変化は,血中コレステロール減少に伴う肝臓でのリポプロテ
イン又はコレステロールの合成亢進による変化と推察される門脈周囲における肝細胞肥大のみ
であったこと,これまで本剤の臨床試験で著明なトリグリセリド増加に至っていないこと,認
められた脂質の変動は本剤の第 1 相試験において投与終了後速やかに回復したことから
(5.3.3.1-01 参照),総じて脂質への影響が更なる有害事象に繋がる懸念は低いと判断した.
2.4.5
総括及び結論
本剤の薬理学的,薬物動態学的及び毒性学的プロファイルを明らかにするために適切な用量
を設定して非臨床試験を実施した.非臨床試験の成績から,ヒトで注意すべき本剤の毒性所見
として,摂餌量の減少,赤血球系パラメータの減少,多臓器における炎症性変化,血小板数の
減少及び嘔吐が認められた.上記所見が認められた曝露量と申請用法用量におけるヒト曝露量
の間に 2~3倍の乖離があり,嘔吐を除き,毒性試験で認められた所見は臨床試験では認められ
ていない.生殖発生毒性試験では,ウサギで胚致死並びに胎児の椎骨・肋骨・胸骨分節等の軸
骨格形態異常及び短尾が認められたことから,S-217622 フマル酸共結晶は妊婦又は妊娠してい
る可能性のある女性には,投与すべきでないと考える.また,出生前及び出生後の発生並びに
母体の機能に関する試験において,妊娠後期及び哺育期間中の投与により児の発生並びに発育
に影響を示す可能性が示唆された.S-217622 フマル酸共結晶はラットの胎盤を通じて胎児に移
行すると共に授乳ラットの乳汁に移行するが,ヒトの乳汁への移行は不明である.また,一般
毒性試験の安全域を踏まえるとヒトで哺乳中の児における影響は否定できない.以上より,授
乳婦については,S-217622 フマル酸共結晶は投与期間中及び投与終了後一定期間は授乳しない
30
2.4 非臨床の概括評価
ズの大きくなった画分であると考えられる [34].また,HDL によるコレステロール回収への影
響に関する in vitro 試験を実施した結果,S-217622 が HDL によるコレステロール回収能及び
LCAT を直接的に阻害する可能性は低いと考えられた (2.6.6.8.2.1 項及び 2.6.6.8.2.2 項参照).以
上のことから,S-217622 による HDL コレステロール減少は,HDL がコレステロールを回収し
た以降の成熟過程又は排泄に影響したことに起因すると推察されたが,その機序は不明であっ
た.
本剤の第 1 相試験の 750/250 mg 投与時の脂質解析の結果,HDL コレステロール減少の他に
認められた主な変化は小型 LDL のコレステロール減少,並びに大型 LDL 及び小型 VLDL のト
リグリセリドの増加であった.HDL 中のコレステロールは,LCAT によりエステル化された後
に,コレステリルエステル転送タンパク (CETP) によって LDL 及び VLDL 分画のトリグリセ
リドと交換される [35].S-217622 の投与により中型 HDL のコレステロール減少が起こり,そ
の二次的変化として CETP による HDL コレステロールと LDL 及び VLDL のトリグリセリドの
交換が減少し,小型 LDL のコレステロール減少や,小型 VLDL 及び大型 LDL のトリグリセリ
ド増加等の変化が生じたと考えられた.S-217622 フマル酸共結晶のサル 4 週間反復経口投与毒
性試験において,投与 10 及び 27 日目に 10 mg/kg/日以上の用量で HDL 及び LDL コレステロー
ル減少が認められた.10 mg/kg/日の用量では総コレステロールの減少,並びに 30 mg/kg/日の用
量では総コレステロールの増加及びトリグリセリドの増加を伴っていた.また病理組織学的検
査では,門脈周囲における肝細胞肥大が認められた (2.6.6.3.4 項参照).サルで認められた脂質
の変動に関連する病理組織学的な変化は,血中コレステロール減少に伴う肝臓でのリポプロテ
イン又はコレステロールの合成亢進による変化と推察される門脈周囲における肝細胞肥大のみ
であったこと,これまで本剤の臨床試験で著明なトリグリセリド増加に至っていないこと,認
められた脂質の変動は本剤の第 1 相試験において投与終了後速やかに回復したことから
(5.3.3.1-01 参照),総じて脂質への影響が更なる有害事象に繋がる懸念は低いと判断した.
2.4.5
総括及び結論
本剤の薬理学的,薬物動態学的及び毒性学的プロファイルを明らかにするために適切な用量
を設定して非臨床試験を実施した.非臨床試験の成績から,ヒトで注意すべき本剤の毒性所見
として,摂餌量の減少,赤血球系パラメータの減少,多臓器における炎症性変化,血小板数の
減少及び嘔吐が認められた.上記所見が認められた曝露量と申請用法用量におけるヒト曝露量
の間に 2~3倍の乖離があり,嘔吐を除き,毒性試験で認められた所見は臨床試験では認められ
ていない.生殖発生毒性試験では,ウサギで胚致死並びに胎児の椎骨・肋骨・胸骨分節等の軸
骨格形態異常及び短尾が認められたことから,S-217622 フマル酸共結晶は妊婦又は妊娠してい
る可能性のある女性には,投与すべきでないと考える.また,出生前及び出生後の発生並びに
母体の機能に関する試験において,妊娠後期及び哺育期間中の投与により児の発生並びに発育
に影響を示す可能性が示唆された.S-217622 フマル酸共結晶はラットの胎盤を通じて胎児に移
行すると共に授乳ラットの乳汁に移行するが,ヒトの乳汁への移行は不明である.また,一般
毒性試験の安全域を踏まえるとヒトで哺乳中の児における影響は否定できない.以上より,授
乳婦については,S-217622 フマル酸共結晶は投与期間中及び投与終了後一定期間は授乳しない
30