よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
2.4 非臨床の概括評価
目次
略号及び用語定義一覧表 ............................................................................................................................. 4
2.4
非臨床試験の概括評価 .............................................................................................................. 7
2.4.1
非臨床試験計画概略 .......................................................................................................... 7
2.4.2
薬理試験 .............................................................................................................................. 8
2.4.2.1
効力を裏付ける試験 .................................................................................................. 8
2.4.2.1.1
作用機序 .............................................................................................................. 8
2.4.2.1.2
In vitro 活性 ......................................................................................................... 8
2.4.2.1.3
In vivo 活性 .......................................................................................................... 9
2.4.2.1.4
臨床で有効性が期待できる血漿中濃度......................................................... 10
2.4.2.1.5
S-217622 フマル酸共結晶に対する感受性低下 ............................................ 11
2.4.2.2
副次的薬理試験 ........................................................................................................ 11
2.4.2.3
安全性薬理試験 ........................................................................................................ 12
2.4.3
薬物動態試験 .................................................................................................................... 13
2.4.4
毒性試験 ............................................................................................................................ 19
2.4.4.1
単回投与毒性試験 .................................................................................................... 19
2.4.4.2
反復投与毒性試験 .................................................................................................... 20
2.4.4.3
遺伝毒性試験 ............................................................................................................ 26
2.4.4.4
がん原性試験 ............................................................................................................ 26
2.4.4.5
生殖発生毒性試験 .................................................................................................... 26
2.4.4.6
局所刺激性試験 ........................................................................................................ 29
2.4.4.7
その他の毒性試験 .................................................................................................... 29
2.4.5
総括及び結論 .................................................................................................................... 30
2.4.6
参考文献一覧 .................................................................................................................... 31
表
表 2.4.2-1
マウスへの感染 24 時間後投与時の初回投与から 48 時間後の肺内ウイルス
力価低下と C48hr/PA-EC50 の関係性 ................................................................................ 10
表 2.4.2-2
安全性薬理コアバッテリー試験結果及び血漿中曝露量と申請用法用量にお
ける血漿中曝露量との比 ................................................................................................ 13
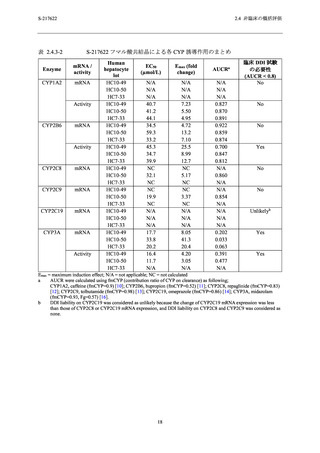
表 2.4.3-1
S-217622 フマル酸共結晶による各 CYP 阻害作用のまとめ ...................................... 17
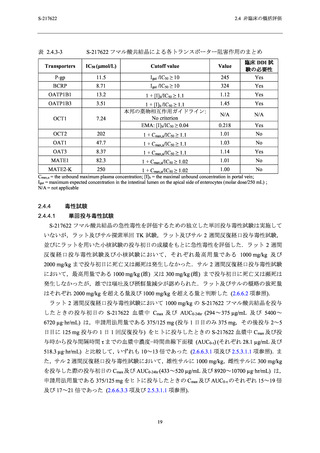
表 2.4.3-2
S-217622 フマル酸共結晶による各 CYP 誘導作用のまとめ ...................................... 18
表 2.4.3-3
S-217622 フマル酸共結晶による各トランスポーター阻害作用のまとめ ................ 19
表 2.4.4-1
S-217622 フマル酸共結晶の反復経口投与毒性試験における主な毒性所見 ............ 25
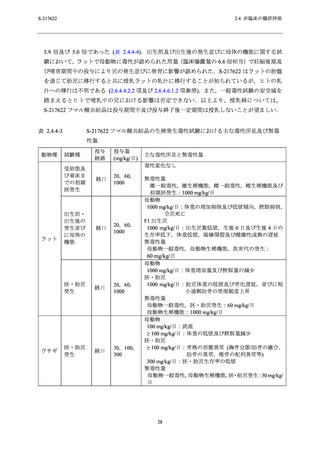
表 2.4.4-2
S-217622 フマル酸共結晶の反復経口投与毒性試験における無毒性量と
2
2.4 非臨床の概括評価
目次
略号及び用語定義一覧表 ............................................................................................................................. 4
2.4
非臨床試験の概括評価 .............................................................................................................. 7
2.4.1
非臨床試験計画概略 .......................................................................................................... 7
2.4.2
薬理試験 .............................................................................................................................. 8
2.4.2.1
効力を裏付ける試験 .................................................................................................. 8
2.4.2.1.1
作用機序 .............................................................................................................. 8
2.4.2.1.2
In vitro 活性 ......................................................................................................... 8
2.4.2.1.3
In vivo 活性 .......................................................................................................... 9
2.4.2.1.4
臨床で有効性が期待できる血漿中濃度......................................................... 10
2.4.2.1.5
S-217622 フマル酸共結晶に対する感受性低下 ............................................ 11
2.4.2.2
副次的薬理試験 ........................................................................................................ 11
2.4.2.3
安全性薬理試験 ........................................................................................................ 12
2.4.3
薬物動態試験 .................................................................................................................... 13
2.4.4
毒性試験 ............................................................................................................................ 19
2.4.4.1
単回投与毒性試験 .................................................................................................... 19
2.4.4.2
反復投与毒性試験 .................................................................................................... 20
2.4.4.3
遺伝毒性試験 ............................................................................................................ 26
2.4.4.4
がん原性試験 ............................................................................................................ 26
2.4.4.5
生殖発生毒性試験 .................................................................................................... 26
2.4.4.6
局所刺激性試験 ........................................................................................................ 29
2.4.4.7
その他の毒性試験 .................................................................................................... 29
2.4.5
総括及び結論 .................................................................................................................... 30
2.4.6
参考文献一覧 .................................................................................................................... 31
表
表 2.4.2-1
マウスへの感染 24 時間後投与時の初回投与から 48 時間後の肺内ウイルス
力価低下と C48hr/PA-EC50 の関係性 ................................................................................ 10
表 2.4.2-2
安全性薬理コアバッテリー試験結果及び血漿中曝露量と申請用法用量にお
ける血漿中曝露量との比 ................................................................................................ 13
表 2.4.3-1
S-217622 フマル酸共結晶による各 CYP 阻害作用のまとめ ...................................... 17
表 2.4.3-2
S-217622 フマル酸共結晶による各 CYP 誘導作用のまとめ ...................................... 18
表 2.4.3-3
S-217622 フマル酸共結晶による各トランスポーター阻害作用のまとめ ................ 19
表 2.4.4-1
S-217622 フマル酸共結晶の反復経口投与毒性試験における主な毒性所見 ............ 25
表 2.4.4-2
S-217622 フマル酸共結晶の反復経口投与毒性試験における無毒性量と
2