よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
2.4 非臨床の概括評価
毒性変化 (死亡/瀕死,嘔吐,摂餌量の減少,赤血球系パラメータの減少,血小板数の減少及び
多臓器における炎症性変化),並びにビリルビンの増加について,以下に考察する.コレステロー
ルへの影響については,第 1 相試験 (T1211 試験) において認められた HDL コレステロールの
減少及びトリグリセリドの増加の発現機序を検討する目的で実施した試験の結果と共に 2.4.4.7
項で考察する.
●
死亡/瀕死の原因
サル 2 週間反復経口投与毒性試験において,1000 又は 300 mg/kg/日の用量を反復投与した雄
2 例と 300 mg/kg/日の用量を反復投与した雌 1 例で,嘔吐又は摂餌量減少を示した後に死亡又は
瀕死が認められた.雄 2 例の死亡/瀕死例は,ストレス下にあったことを示唆する変化 (副腎皮
質の肥大,胸腺皮質の単細胞壊死) 並びにそれに伴う免疫抑制性の変化 (脾臓やリンパ節にお
けるリンパ球減少,末梢血中リンパ球数の減少) 及び多臓器における感染性変化 (顎下リンパ
節に菌塊を伴う重篤な化膿性炎,菌塊を伴う骨髄炎,心臓・肝臓・肺の血管内の炎症性細胞の
集簇) が認められたことから,嘔吐や摂餌量減少による状態悪化及びストレスにより免疫抑制
状態となり,日和見感染により死に至ったと考えられた.雌 1 例の瀕死例では,摂餌量減少及
び貧血により全身状態が悪化し,瀕死に至ったと考えられた (2.6.6.3.3 項参照).
サル 2 週間反復経口投与毒性試験において死亡/瀕死が認められなかった 50 mg/kg/日におけ
る投与 14 日目の Cmax 及び AUC0-24hr (それぞれ 378~404 µg/mL 及び 7390~7810 µg·hr/mL) は,
申請用法用量における Cmax 及び AUC0-τ (28.1 µg/mL 及び 518.3 µg·hr/mL) と比較して,それぞれ
13~14 倍及び 14~15倍であった (2.6.6.3.3 項及び 2.5.3.1.1 項参照).一方で,瀕死又は死亡例が
認められた 300 mg/kg/日以上の用量で投与した際の Cmax は 409 µg/mL (769 µmol/L) 以上であり,
サル 2 週間反復経口投与毒性試験の馴化期間中の血漿中アルブミン濃度 (3.5~4.5 g/dL [530~
682 µmol/L]) を超えている.さらに,瀕死例では摂餌低下や炎症性変化に起因して低アルブミ
ン血症 (血漿中アルブミン濃度:2.8 又は 3.0 g/dL [424 又は 455 µmol/L]) を呈していたため,上
述のように死亡及び瀕死例では非結合型の血漿中 S-217622 濃度の増加に伴い,毒性が強く発現
したと考えられた.一方,申請用法用量における Cmax は 28.1 µg/mL (52.8 µmol/L) であり,ヒト
のアルブミン濃度 (4.1~5.1 g/dL [621~773 µmol/L] [18]) に対し血漿中薬物濃度が十分に低いた
め,ヒトではアルブミン結合の飽和による非結合型の血漿中 S-217622 濃度の増加が起こる可能
性は低いと考えられた.
死亡/瀕死の要因と考えられる日和見感染や貧血,それに関連する有害事象は,本剤の第 1 相
及び第 2/3 相試験において認められていない.死亡/瀕死例に認められた摂餌量減少や嘔吐は,
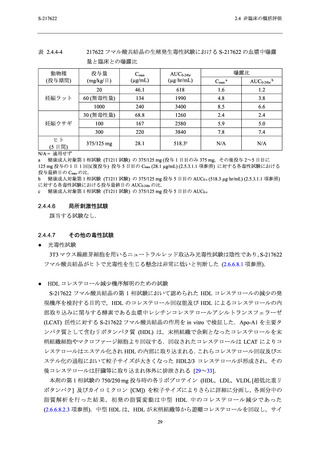
他の生存例でも認められており,表 2.4.4-2 に示す通り,申請用法用量における曝露量はサル
2週間及び 4週間反復経口投与毒性試験の無毒性量における曝露量の範囲内である.さらに,本
剤の第 1 相及び第 2/3 相試験では食欲に関連する有害事象は現時点では認められておらず,軽
度の嘔吐及び悪心が発現したものの,重篤なものは認められなかった (2.5.5.2 項).
以上のことから,申請用法用量では,死亡/瀕死に至る重篤な有害事象発現の可能性は極めて
低いと考えられる.
21
2.4 非臨床の概括評価
毒性変化 (死亡/瀕死,嘔吐,摂餌量の減少,赤血球系パラメータの減少,血小板数の減少及び
多臓器における炎症性変化),並びにビリルビンの増加について,以下に考察する.コレステロー
ルへの影響については,第 1 相試験 (T1211 試験) において認められた HDL コレステロールの
減少及びトリグリセリドの増加の発現機序を検討する目的で実施した試験の結果と共に 2.4.4.7
項で考察する.
●
死亡/瀕死の原因
サル 2 週間反復経口投与毒性試験において,1000 又は 300 mg/kg/日の用量を反復投与した雄
2 例と 300 mg/kg/日の用量を反復投与した雌 1 例で,嘔吐又は摂餌量減少を示した後に死亡又は
瀕死が認められた.雄 2 例の死亡/瀕死例は,ストレス下にあったことを示唆する変化 (副腎皮
質の肥大,胸腺皮質の単細胞壊死) 並びにそれに伴う免疫抑制性の変化 (脾臓やリンパ節にお
けるリンパ球減少,末梢血中リンパ球数の減少) 及び多臓器における感染性変化 (顎下リンパ
節に菌塊を伴う重篤な化膿性炎,菌塊を伴う骨髄炎,心臓・肝臓・肺の血管内の炎症性細胞の
集簇) が認められたことから,嘔吐や摂餌量減少による状態悪化及びストレスにより免疫抑制
状態となり,日和見感染により死に至ったと考えられた.雌 1 例の瀕死例では,摂餌量減少及
び貧血により全身状態が悪化し,瀕死に至ったと考えられた (2.6.6.3.3 項参照).
サル 2 週間反復経口投与毒性試験において死亡/瀕死が認められなかった 50 mg/kg/日におけ
る投与 14 日目の Cmax 及び AUC0-24hr (それぞれ 378~404 µg/mL 及び 7390~7810 µg·hr/mL) は,
申請用法用量における Cmax 及び AUC0-τ (28.1 µg/mL 及び 518.3 µg·hr/mL) と比較して,それぞれ
13~14 倍及び 14~15倍であった (2.6.6.3.3 項及び 2.5.3.1.1 項参照).一方で,瀕死又は死亡例が
認められた 300 mg/kg/日以上の用量で投与した際の Cmax は 409 µg/mL (769 µmol/L) 以上であり,
サル 2 週間反復経口投与毒性試験の馴化期間中の血漿中アルブミン濃度 (3.5~4.5 g/dL [530~
682 µmol/L]) を超えている.さらに,瀕死例では摂餌低下や炎症性変化に起因して低アルブミ
ン血症 (血漿中アルブミン濃度:2.8 又は 3.0 g/dL [424 又は 455 µmol/L]) を呈していたため,上
述のように死亡及び瀕死例では非結合型の血漿中 S-217622 濃度の増加に伴い,毒性が強く発現
したと考えられた.一方,申請用法用量における Cmax は 28.1 µg/mL (52.8 µmol/L) であり,ヒト
のアルブミン濃度 (4.1~5.1 g/dL [621~773 µmol/L] [18]) に対し血漿中薬物濃度が十分に低いた
め,ヒトではアルブミン結合の飽和による非結合型の血漿中 S-217622 濃度の増加が起こる可能
性は低いと考えられた.
死亡/瀕死の要因と考えられる日和見感染や貧血,それに関連する有害事象は,本剤の第 1 相
及び第 2/3 相試験において認められていない.死亡/瀕死例に認められた摂餌量減少や嘔吐は,
他の生存例でも認められており,表 2.4.4-2 に示す通り,申請用法用量における曝露量はサル
2週間及び 4週間反復経口投与毒性試験の無毒性量における曝露量の範囲内である.さらに,本
剤の第 1 相及び第 2/3 相試験では食欲に関連する有害事象は現時点では認められておらず,軽
度の嘔吐及び悪心が発現したものの,重篤なものは認められなかった (2.5.5.2 項).
以上のことから,申請用法用量では,死亡/瀕死に至る重篤な有害事象発現の可能性は極めて
低いと考えられる.
21