よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
S-217622
2.4 非臨床の概括評価
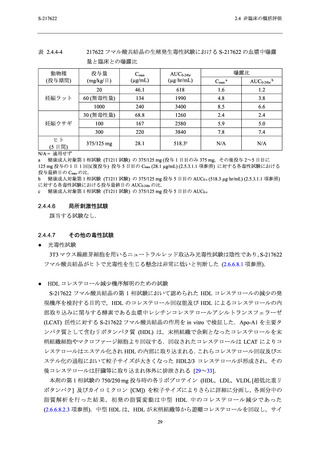
1000 mg/kg/日投与群で軽度の発育遅延及び骨格変異所見として短小過剰肋骨の増加が認められ
たが,この変化は成長に伴い消失する変化として知られている [26, 27].以上の結果から,雌雄
の生殖機能,初期胚発生に関する無毒性量は 1000 mg/kg/日,胚・胎児発生,雄及び母動物の一
般毒性に関する無毒性量は 60 mg/kg/日と判断した (2.6.6.6.2 項参照).受胎能及び初期胚発生に
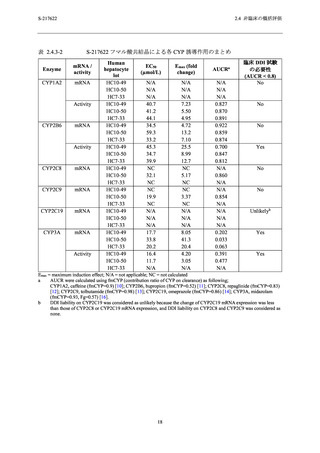
関する試験における血漿中曝露量は測定していないが,ラット 4 週間反復経口投与毒性試験の
1000 mg/kg/日における Cmax 及び AUC0-24hr は,申請用法用量 (375/125 mg) における曝露量のそ
れぞれ 9~13 倍及び 8~10 倍であった (表 2.4.4-2).
ウサギ胚・胎児発生に関する試験 (投与量:30,100 及び 300 mg/kg/日) では,100 mg/kg/日以
上の用量で,母動物において摂餌抑制を伴う体重減少が認められ,胎児の骨格異常 (椎骨・肋
骨・胸骨分節等の軸骨格形態異常) 及び短尾が認められた.また,300 mg/kg/日の用量では胚・
胎児生存率の低値が認められた.さらに,顕著な摂餌量減少を示した 100 mg/kg/日の 1 例にお
いて流産が認められた (2.6.6.6.3 項参照).妊娠ウサギでは顕著な摂餌抑制による流産及び早産
が報告されていることから [28],本試験で認められた流産は S-217622 フマル酸共結晶投与によ
る摂餌量減少に起因していると推察された.これらの結果から,本試験における母動物の一般
毒性,母動物の生殖毒性及び胚・胎児発生に関する無毒性量はいずれも 30 mg/kg/日と判断した.
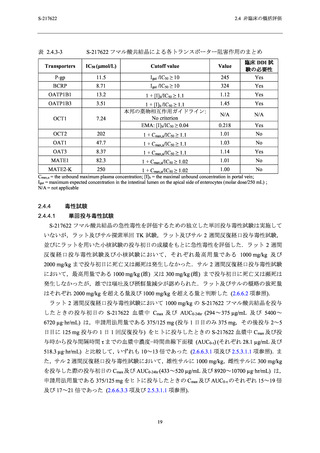
妊娠ウサギにおける血漿中 S-217622 の曝露量 (Cmax 及び AUC0-24hr) は,それぞれ 68.8 µg/mL 及
び 1260 µg·hr/mL であり,申請用法用量 (375/125 mg) における曝露量のいずれも 2.4 倍であっ
た (表 2.4.4-4).胎児の軸骨格の形態異常に対する母体毒性の関与,並びに短期間の S-217622 フ
マル酸共結晶の投与が胚・胎児発生に与える影響を検討する目的で,短期間投与 (3~4 日) の
ウサギ胚・胎児発生に関する追加試験 (投与量:300 mg/kg/日) を実施した.その結果,短期間
の投与においても胚・胎児の致死及び軸骨格の形態異常等が認められ,その発現頻度は器官形
成期の初期段階でより顕著であった.よって,胎児の軸骨格の形態異常と母体毒性との関連は
明らかにならなかった (2.6.6.6.4 項参照).
ラット出生前及び出生後の発生並びに母体の機能に関する試験 (投与量:20,60 及び
1000 mg/kg/日) では,1000 mg/kg/日の母動物で,体重の増加抑制及び低値傾向,摂餌抑制,並
びに 5/20 例において哺育初期に全児死亡が認められた.また,1000 mg/kg/日投与群の F1 出生
児で,母体毒性に起因したと考えられる出生児数,生後 0 日及び生後 4日生存率及び哺育期間
を通じた出生児体重の低値,また,眼瞼開裂及び雌雄の性成熟の遅延が認められた.以上の結
果から,本試験における母動物の生殖機能及び一般毒性並びに次世代の発生に関する無毒性量
は 60 mg/kg/日と判断した (2.6.6.6.5 項参照).
本試験において血漿中曝露量は測定していないが,
本試験の無毒性量における妊娠ラットの曝露量 (Cmax 及び AUC0-24hr) は,ラット胚・胎児発生
に関する試験の曝露量を参照すると,それぞれ 134 µg/mL 及び 1990 µg·hr/mL であり,申請用法
用量 (375/125 mg) における血漿中曝露量のそれぞれ 4.8 倍及び 3.8 倍であった (表 2.4.4-4).
以上のように,生殖発生毒性試験において,ウサギで胎児の椎骨・肋骨・胸骨分節等の軸骨
格形態異常及び短尾が 100 mg/kg/日以上の用量で認められたことから,S-217622 フマル酸共結
晶は妊婦又は妊娠している可能性のある女性には,投与すべきでないと考える.妊娠ウサギに
100 mg/kg/日投与したときの血漿中 S-217622 の曝露量 (Cmax 及び AUC0-24hr) は,それぞれ
167 µg/mL 及び 2580 µg·hr/mL であり,申請用法用量 (375/125 mg) における曝露量のそれぞれ
27
2.4 非臨床の概括評価
1000 mg/kg/日投与群で軽度の発育遅延及び骨格変異所見として短小過剰肋骨の増加が認められ
たが,この変化は成長に伴い消失する変化として知られている [26, 27].以上の結果から,雌雄
の生殖機能,初期胚発生に関する無毒性量は 1000 mg/kg/日,胚・胎児発生,雄及び母動物の一
般毒性に関する無毒性量は 60 mg/kg/日と判断した (2.6.6.6.2 項参照).受胎能及び初期胚発生に
関する試験における血漿中曝露量は測定していないが,ラット 4 週間反復経口投与毒性試験の
1000 mg/kg/日における Cmax 及び AUC0-24hr は,申請用法用量 (375/125 mg) における曝露量のそ
れぞれ 9~13 倍及び 8~10 倍であった (表 2.4.4-2).
ウサギ胚・胎児発生に関する試験 (投与量:30,100 及び 300 mg/kg/日) では,100 mg/kg/日以
上の用量で,母動物において摂餌抑制を伴う体重減少が認められ,胎児の骨格異常 (椎骨・肋
骨・胸骨分節等の軸骨格形態異常) 及び短尾が認められた.また,300 mg/kg/日の用量では胚・
胎児生存率の低値が認められた.さらに,顕著な摂餌量減少を示した 100 mg/kg/日の 1 例にお
いて流産が認められた (2.6.6.6.3 項参照).妊娠ウサギでは顕著な摂餌抑制による流産及び早産
が報告されていることから [28],本試験で認められた流産は S-217622 フマル酸共結晶投与によ
る摂餌量減少に起因していると推察された.これらの結果から,本試験における母動物の一般
毒性,母動物の生殖毒性及び胚・胎児発生に関する無毒性量はいずれも 30 mg/kg/日と判断した.
妊娠ウサギにおける血漿中 S-217622 の曝露量 (Cmax 及び AUC0-24hr) は,それぞれ 68.8 µg/mL 及
び 1260 µg·hr/mL であり,申請用法用量 (375/125 mg) における曝露量のいずれも 2.4 倍であっ
た (表 2.4.4-4).胎児の軸骨格の形態異常に対する母体毒性の関与,並びに短期間の S-217622 フ
マル酸共結晶の投与が胚・胎児発生に与える影響を検討する目的で,短期間投与 (3~4 日) の
ウサギ胚・胎児発生に関する追加試験 (投与量:300 mg/kg/日) を実施した.その結果,短期間
の投与においても胚・胎児の致死及び軸骨格の形態異常等が認められ,その発現頻度は器官形
成期の初期段階でより顕著であった.よって,胎児の軸骨格の形態異常と母体毒性との関連は
明らかにならなかった (2.6.6.6.4 項参照).
ラット出生前及び出生後の発生並びに母体の機能に関する試験 (投与量:20,60 及び
1000 mg/kg/日) では,1000 mg/kg/日の母動物で,体重の増加抑制及び低値傾向,摂餌抑制,並
びに 5/20 例において哺育初期に全児死亡が認められた.また,1000 mg/kg/日投与群の F1 出生
児で,母体毒性に起因したと考えられる出生児数,生後 0 日及び生後 4日生存率及び哺育期間
を通じた出生児体重の低値,また,眼瞼開裂及び雌雄の性成熟の遅延が認められた.以上の結
果から,本試験における母動物の生殖機能及び一般毒性並びに次世代の発生に関する無毒性量
は 60 mg/kg/日と判断した (2.6.6.6.5 項参照).
本試験において血漿中曝露量は測定していないが,
本試験の無毒性量における妊娠ラットの曝露量 (Cmax 及び AUC0-24hr) は,ラット胚・胎児発生
に関する試験の曝露量を参照すると,それぞれ 134 µg/mL 及び 1990 µg·hr/mL であり,申請用法
用量 (375/125 mg) における血漿中曝露量のそれぞれ 4.8 倍及び 3.8 倍であった (表 2.4.4-4).
以上のように,生殖発生毒性試験において,ウサギで胎児の椎骨・肋骨・胸骨分節等の軸骨
格形態異常及び短尾が 100 mg/kg/日以上の用量で認められたことから,S-217622 フマル酸共結
晶は妊婦又は妊娠している可能性のある女性には,投与すべきでないと考える.妊娠ウサギに
100 mg/kg/日投与したときの血漿中 S-217622 の曝露量 (Cmax 及び AUC0-24hr) は,それぞれ
167 µg/mL 及び 2580 µg·hr/mL であり,申請用法用量 (375/125 mg) における曝露量のそれぞれ
27