よむ、つかう、まなぶ。
資料1 後発医薬品産業の現状等について (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34511.html |
| 出典情報 | 後発医薬品の安定供給等の実現に向けた 産業構造のあり方に関する検討会(第1回 7/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年2月15日 第9回「医薬
品の迅速・安定供給実現に向けた総
合対策に関する有識者検討会」資料
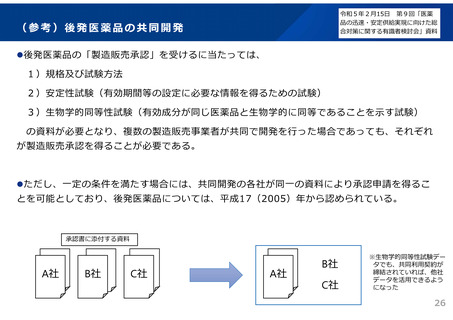
(参考)後発医薬品の共同開発
後発医薬品の「製造販売承認」を受けるに当たっては、
1)規格及び試験方法
2)安定性試験(有効期間等の設定に必要な情報を得るための試験)
3)生物学的同等性試験(有効成分が同じ医薬品と生物学的に同等であることを示す試験)
の資料が必要となり、複数の製造販売事業者が共同で開発を行った場合であっても、それぞれ
が製造販売承認を得ることが必要である。
ただし、一定の条件を満たす場合には、共同開発の各社が同一の資料により承認申請を得るこ
とを可能としており、後発医薬品については、平成17(2005)年から認められている。
承認書に添付する資料
A社
B社
C社
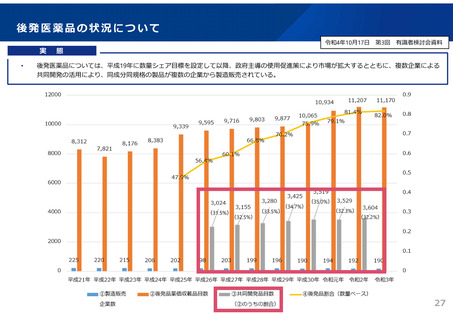
A社
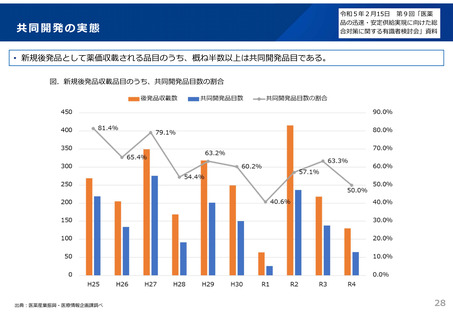
B社
C社
※生物学的同等性試験デー
タでも、共同利用契約が
締結されていれば、他社
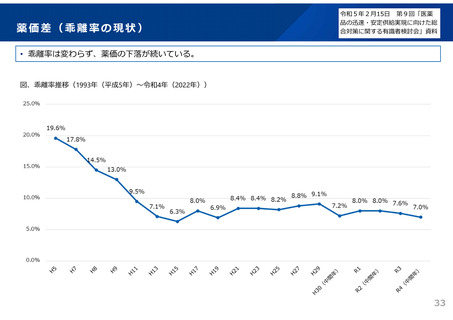
データを活用できるよう
になった
26
品の迅速・安定供給実現に向けた総
合対策に関する有識者検討会」資料
(参考)後発医薬品の共同開発
後発医薬品の「製造販売承認」を受けるに当たっては、
1)規格及び試験方法
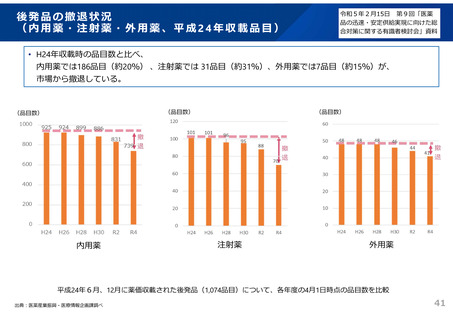
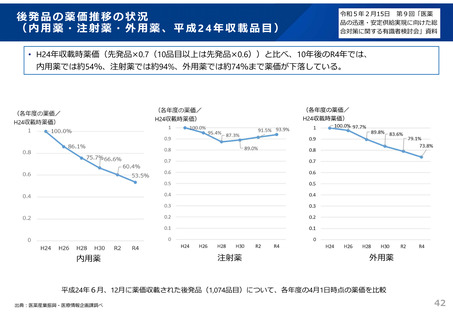
2)安定性試験(有効期間等の設定に必要な情報を得るための試験)
3)生物学的同等性試験(有効成分が同じ医薬品と生物学的に同等であることを示す試験)
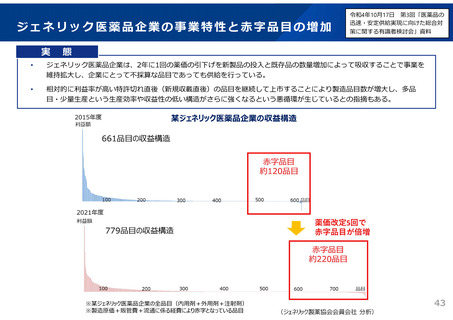
の資料が必要となり、複数の製造販売事業者が共同で開発を行った場合であっても、それぞれ
が製造販売承認を得ることが必要である。
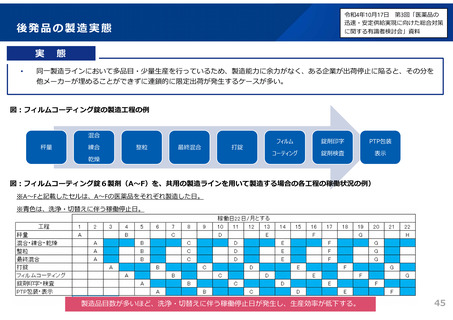
ただし、一定の条件を満たす場合には、共同開発の各社が同一の資料により承認申請を得るこ
とを可能としており、後発医薬品については、平成17(2005)年から認められている。
承認書に添付する資料
A社
B社
C社
A社
B社
C社
※生物学的同等性試験デー
タでも、共同利用契約が
締結されていれば、他社
データを活用できるよう
になった
26