よむ、つかう、まなぶ。
資料1-2 日本OTC医薬品協会 御提出資料 (14 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/231211/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 12/11)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
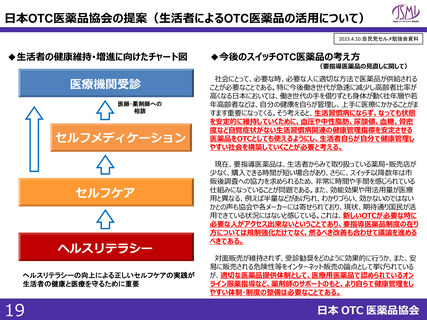
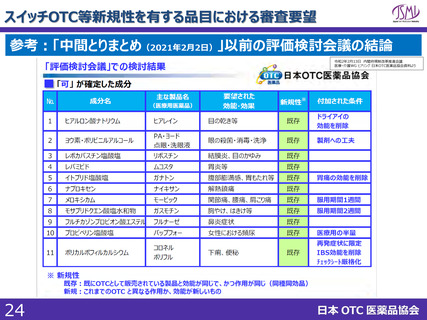
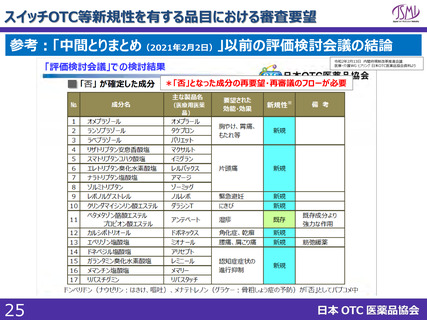
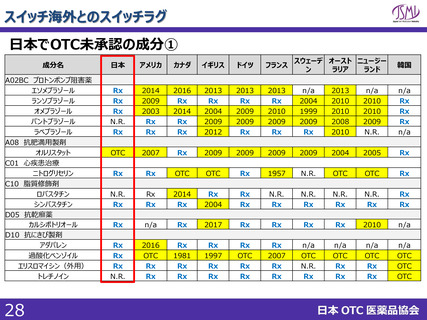
スイッチOTC等新規性を有する品目における審査要望
2.企業が申請した品目を評価検討会議では
議論しないこと
① 厚労省・PMDAの承認審査では、薬機法に基づき、当該医薬品の有効性、安
全性、品質が適切なレベルにあるかどうか、また、適正使用をどうしたら確保でき
るかその必要な措置の内容を確認している。
② 評価検討会議においては、スイッチOTCとして適切かどうかを医学・薬学・学識・
生活者、業界代表等の構成員で検討しているが、どうしても、当該医薬品の安
全性・有効性の観点から、スイッチOTCとしての妥当性に関する議論にならざるえ
ない。
③ どのような整理を行なっても、承認審査と評価検討会議の検討内容は、重複が
生じてしまう。現在、評価検討会議で行なっている「課題の整理」も、スイッチ
OTCとして有効性、安全性の確保ができるかどうか、また、適正使用措置としてど
のような内容が必要かを整理している。
14
2.企業が申請した品目を評価検討会議では
議論しないこと
① 厚労省・PMDAの承認審査では、薬機法に基づき、当該医薬品の有効性、安
全性、品質が適切なレベルにあるかどうか、また、適正使用をどうしたら確保でき
るかその必要な措置の内容を確認している。
② 評価検討会議においては、スイッチOTCとして適切かどうかを医学・薬学・学識・
生活者、業界代表等の構成員で検討しているが、どうしても、当該医薬品の安
全性・有効性の観点から、スイッチOTCとしての妥当性に関する議論にならざるえ
ない。
③ どのような整理を行なっても、承認審査と評価検討会議の検討内容は、重複が
生じてしまう。現在、評価検討会議で行なっている「課題の整理」も、スイッチ
OTCとして有効性、安全性の確保ができるかどうか、また、適正使用措置としてど
のような内容が必要かを整理している。
14