よむ、つかう、まなぶ。
資料1-2 日本OTC医薬品協会 御提出資料 (33 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/231211/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 12/11)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
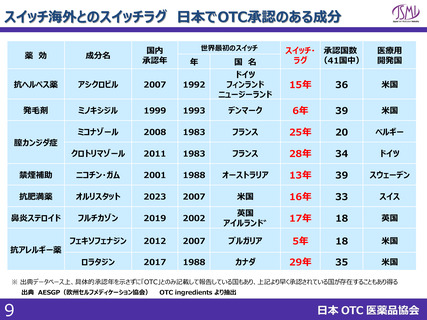
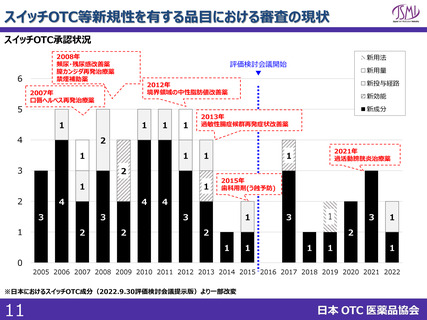
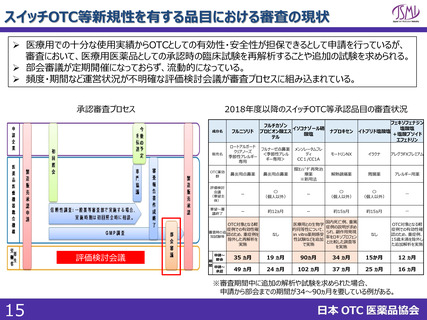
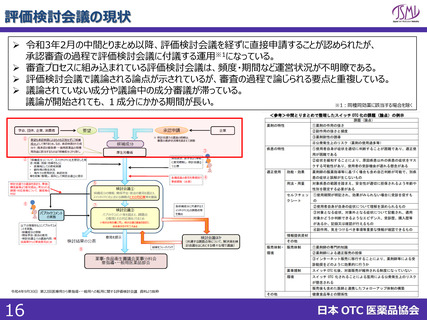
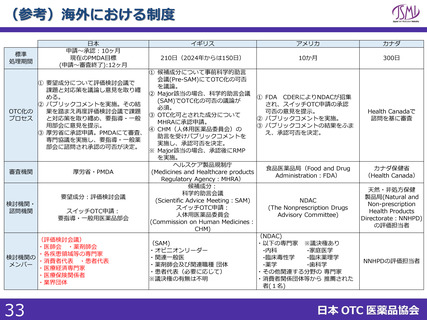
(参考)海外における制度
標準
処理期間
日本
申請~承認:10ヶ月
現在のPMDA目標
(申請~審査終了):12ヶ月
イギリス
アメリカ
カナダ
210日(2024年からは150日)
10か月
300日
① 候補成分について事前科学的助言
会議(Pre-SAM)にてOTC化の可否
① 要望成分について評価検討会議で
を議論。
課題と対応策を議論し意見を取り纏
② Major該当の場合、科学的助言会議
める。
① FDA CDERによりNDACが招集
(SAM)でOTC化の可否の議論が
② パブリックコメントを実施。その結
され、スイッチOTC申請の承認
必須。
OTC化の
果を踏まえ再度評価検討会議で課題
可否の意見を提示。
③ OTC化可とされた成分について
プロセス
と対応策を取り纏め、要指導・一般
② パブリックコメントを実施。
MHRAに承認申請。
用部会に意見を提示。
③ パブリックコメントの結果をふま
④ CHM(人体用医薬品委員会)の
③ 厚労省に承認申請。PMDAにて審査、
え、承認可否を決定。
助言を受けパブリックコメントを
専門協議を実施し、要指導・一般薬
実施し、承認可否を決定。
部会に諮問され承認の可否が決定。
※ Major該当の場合、承認後にRMP
を実施。
ヘルスケア製品規制庁
食品医薬品局(Food and Drug
審査機関
厚労省・PMDA
(Medicines and Healthcare products
Administration:FDA)
Regulatory Agency:MHRA)
候補成分:
科学的助言会議
要望成分:評価検討会議
(Scientific Advice Meeting:SAM)
NDAC
検討機関・
スイッチOTC申請:
(The Nonprescription Drugs
諮問機関
スイッチOTC申請:
人体用医薬品委員会
Advisory Committee)
要指導・一般用医薬品部会
(Commission on Human Medicines:
CHM)
(NDAC)
(評価検討会議)
(SAM)
・以下の専門家 ※議決権あり
・医師会 ・薬剤師会
・オピニオンリーダー
-内科
-家庭医学
・各疾患領域等の専門家
検討機関の
・関連一般医
-臨床毒性学
-臨床薬理学
・消費者代表 ・患者代表
メンバー
・薬剤師会及び関連職種 団体
-薬学
-歯科学
・医療経済専門家
・患者代表(必要に応じて)
・その他関連する分野の 専門家
・医療保険関係者
※議決権の有無は不明
・消費者関係団体等から 推薦された
・業界団体
者(1名)
33
Health Canadaで
諮問を基に審査
カナダ保健省
(Health Canada)
天然・非処方保健
製品局(Natural and
Non-prescription
Health Products
Directorate:NNHPD)
の評価担当者
NNHPDの評価担当者
標準
処理期間
日本
申請~承認:10ヶ月
現在のPMDA目標
(申請~審査終了):12ヶ月
イギリス
アメリカ
カナダ
210日(2024年からは150日)
10か月
300日
① 候補成分について事前科学的助言
会議(Pre-SAM)にてOTC化の可否
① 要望成分について評価検討会議で
を議論。
課題と対応策を議論し意見を取り纏
② Major該当の場合、科学的助言会議
める。
① FDA CDERによりNDACが招集
(SAM)でOTC化の可否の議論が
② パブリックコメントを実施。その結
され、スイッチOTC申請の承認
必須。
OTC化の
果を踏まえ再度評価検討会議で課題
可否の意見を提示。
③ OTC化可とされた成分について
プロセス
と対応策を取り纏め、要指導・一般
② パブリックコメントを実施。
MHRAに承認申請。
用部会に意見を提示。
③ パブリックコメントの結果をふま
④ CHM(人体用医薬品委員会)の
③ 厚労省に承認申請。PMDAにて審査、
え、承認可否を決定。
助言を受けパブリックコメントを
専門協議を実施し、要指導・一般薬
実施し、承認可否を決定。
部会に諮問され承認の可否が決定。
※ Major該当の場合、承認後にRMP
を実施。
ヘルスケア製品規制庁
食品医薬品局(Food and Drug
審査機関
厚労省・PMDA
(Medicines and Healthcare products
Administration:FDA)
Regulatory Agency:MHRA)
候補成分:
科学的助言会議
要望成分:評価検討会議
(Scientific Advice Meeting:SAM)
NDAC
検討機関・
スイッチOTC申請:
(The Nonprescription Drugs
諮問機関
スイッチOTC申請:
人体用医薬品委員会
Advisory Committee)
要指導・一般用医薬品部会
(Commission on Human Medicines:
CHM)
(NDAC)
(評価検討会議)
(SAM)
・以下の専門家 ※議決権あり
・医師会 ・薬剤師会
・オピニオンリーダー
-内科
-家庭医学
・各疾患領域等の専門家
検討機関の
・関連一般医
-臨床毒性学
-臨床薬理学
・消費者代表 ・患者代表
メンバー
・薬剤師会及び関連職種 団体
-薬学
-歯科学
・医療経済専門家
・患者代表(必要に応じて)
・その他関連する分野の 専門家
・医療保険関係者
※議決権の有無は不明
・消費者関係団体等から 推薦された
・業界団体
者(1名)
33
Health Canadaで
諮問を基に審査
カナダ保健省
(Health Canada)
天然・非処方保健
製品局(Natural and
Non-prescription
Health Products
Directorate:NNHPD)
の評価担当者
NNHPDの評価担当者