よむ、つかう、まなぶ。
資料1-2 日本OTC医薬品協会 御提出資料 (21 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/231211/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 12/11)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
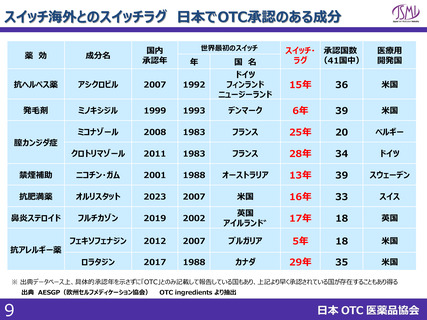
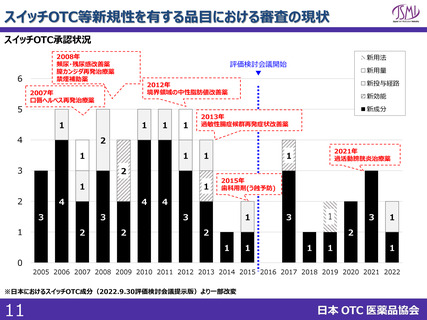
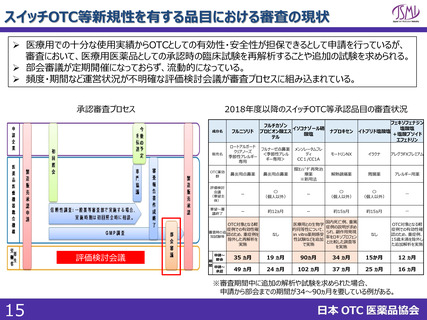
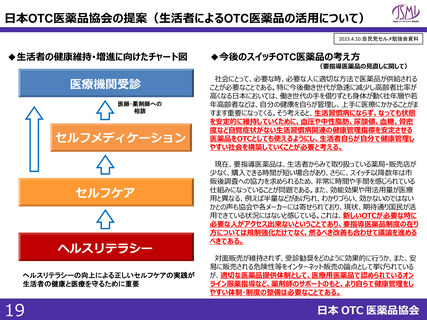
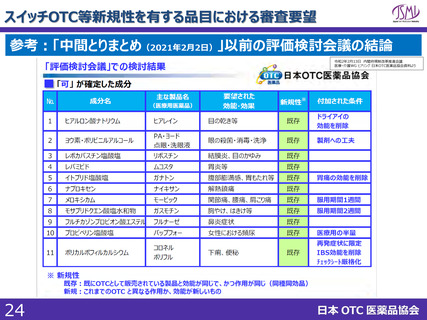
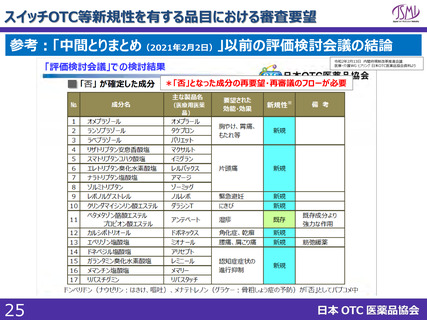
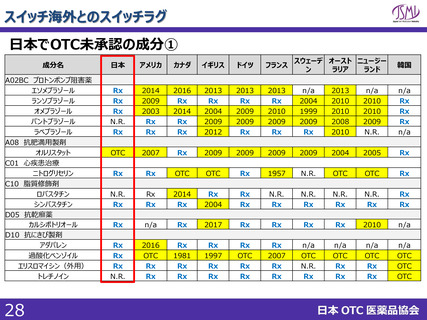
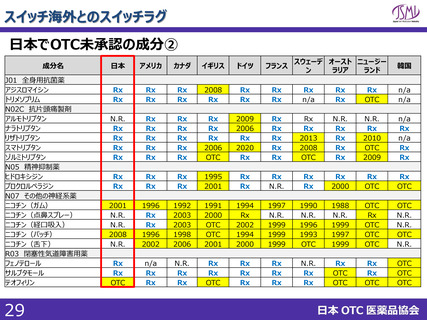
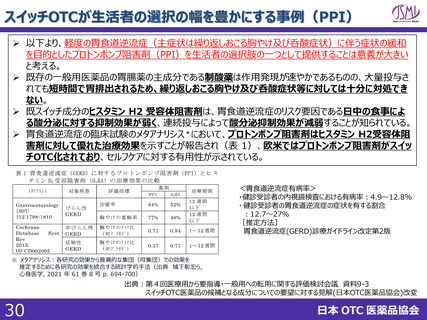
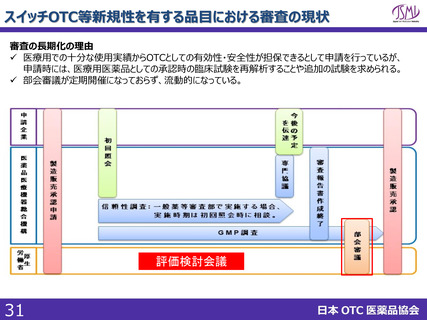
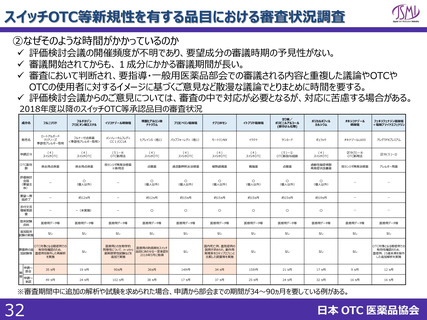
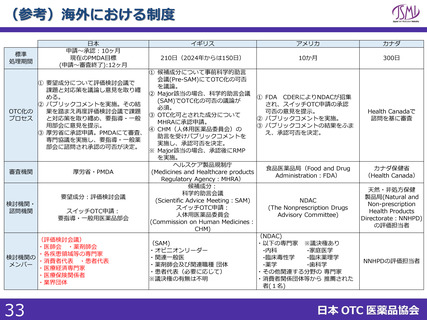
スイッチOTC等新規性を有する品目における審査要望
1. 企業が承認申請してから承認するまでの総審査期間を、評価検討会議
にかけるかけないに関わらず、1年以内で設定すること
現状の課題
<PMDA審査>
✓ 一般用医薬品の申請から承認までの標準的事務処理期間は、新規申請については10ヶ月
(審査側期間のみ)と示されており※1、その後変更はなされていない。 ※1:昭和60年10月1日付薬発第960号
✓ 現状のスイッチOTC審査を鑑みると通知で示されている10ヶ月では予見性を得ることは困難である。
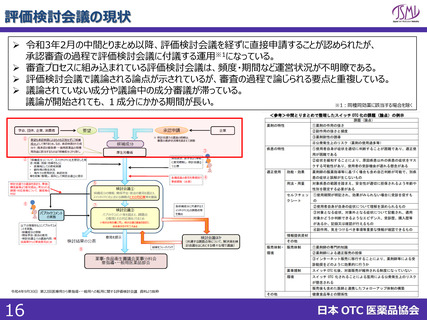
<評価検討会議>
✓ 申請前に評価検討会議に掲題されていない場合、申請後に掲題されるスキームであるが、会議の開催頻度、掲題
スケジュールが定まっていない。個別成分の議論の頻度が低く、中間とりまとめ以降は要望成分の議論が滞っている。
2018年3月16日 要望成分審議
第15回
第16回
第17回
第18回
第19回
2021年3月29日 今後の進め方
2021年6月7日 緊急避妊薬について
2021年10月4日 緊急避妊薬について
2022年1月14日 要望成分審議
2022年3月10日 緊急避妊薬について
第5回
2018年8月1日 要望成分審議
第20回
2022年4月28日 緊急避妊薬について
第6回
2018年12月5日 要望成分審議
第7回
2019年3月14日 要望成分審議
第8回
2019年7月25日 要望成分審議
第9回
2019年12月18日 要望成分審議
第21回
第22回
第23回
第24回
第25回
2022年9月12日 要望成分審議
2022年9月30日 緊急避妊薬について
2022年12月26日 要望成分審議
2023年5月12日 緊急避妊薬について
2023年6月26日 緊急避妊薬について
第1回
2016年4月13日 検討会議運用について
第2回
2017年7月26日 要望成分審議
第3回
2017年11月15日 要望成分審議
第4回
第10回(2020年7月8日)~第14回(2020年12月24日)は中間とりまとめ作成のための議論
解決策と期待される結果
承認審査の総審査期間を1年以内と設定することで、
企業の事業予見性が立ち、事業活動が活性化される。
21
1. 企業が承認申請してから承認するまでの総審査期間を、評価検討会議
にかけるかけないに関わらず、1年以内で設定すること
現状の課題
<PMDA審査>
✓ 一般用医薬品の申請から承認までの標準的事務処理期間は、新規申請については10ヶ月
(審査側期間のみ)と示されており※1、その後変更はなされていない。 ※1:昭和60年10月1日付薬発第960号
✓ 現状のスイッチOTC審査を鑑みると通知で示されている10ヶ月では予見性を得ることは困難である。
<評価検討会議>
✓ 申請前に評価検討会議に掲題されていない場合、申請後に掲題されるスキームであるが、会議の開催頻度、掲題
スケジュールが定まっていない。個別成分の議論の頻度が低く、中間とりまとめ以降は要望成分の議論が滞っている。
2018年3月16日 要望成分審議
第15回
第16回
第17回
第18回
第19回
2021年3月29日 今後の進め方
2021年6月7日 緊急避妊薬について
2021年10月4日 緊急避妊薬について
2022年1月14日 要望成分審議
2022年3月10日 緊急避妊薬について
第5回
2018年8月1日 要望成分審議
第20回
2022年4月28日 緊急避妊薬について
第6回
2018年12月5日 要望成分審議
第7回
2019年3月14日 要望成分審議
第8回
2019年7月25日 要望成分審議
第9回
2019年12月18日 要望成分審議
第21回
第22回
第23回
第24回
第25回
2022年9月12日 要望成分審議
2022年9月30日 緊急避妊薬について
2022年12月26日 要望成分審議
2023年5月12日 緊急避妊薬について
2023年6月26日 緊急避妊薬について
第1回
2016年4月13日 検討会議運用について
第2回
2017年7月26日 要望成分審議
第3回
2017年11月15日 要望成分審議
第4回
第10回(2020年7月8日)~第14回(2020年12月24日)は中間とりまとめ作成のための議論
解決策と期待される結果
承認審査の総審査期間を1年以内と設定することで、
企業の事業予見性が立ち、事業活動が活性化される。
21