よむ、つかう、まなぶ。
参考資料3 「薬害を学ぼう 指導の手引き(改訂版)」 (26 ページ)
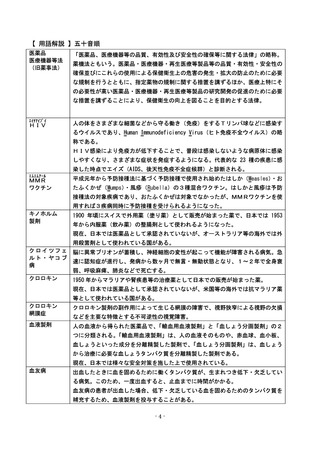
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000197733_00007.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 薬害を学び再発を防止するための教育に関する検討会(第23回 3/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
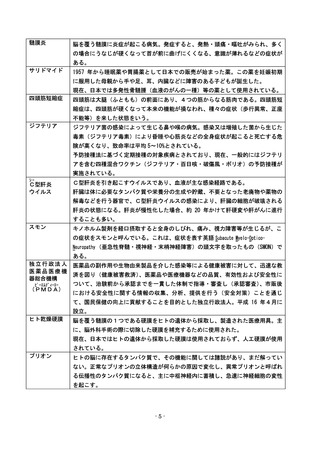
【 補 足② 】
○医薬品をめぐり、社会問題化した最近の具体的な事例を基に、これまでに作られてきた
安全対策の仕組みがどのように機能しているか、他に考えるべき問題点はないか、見て
みよう。
【事例:販売名:イレッサ(一般名:ゲフィチニブ)に関する対応】
○イレッサは、肺がんを治療する錠剤タイプの飲み薬であり、点滴で投与し健康な細胞
にも作用してしまう従来の抗がん剤とは異なり、がん細胞を増殖させる特定の分子を
阻害する新タイプの薬である。肺がんに有効な治療薬がほとんどない中で、早期の承
認に向けた強い期待を集め、肺がんの治験での有効性や副作用情報などを踏まえて、
2002 年、世界に先駆けて日本で承認された。
○販売に当たっては、薬の用法・用量、使用上の注意などを記載した添付文書により、
間質性肺炎<肺の肺胞と肺胞の間の壁(間質)に炎症が起きることにより、肺での酸
素の取り込みが困難になり、呼吸困難や呼吸不全等を生じる病気>が起こりうること
を記載して注意喚起を行っていた。
○販売開始後、イレッサを服用することで腫瘍に対する効果が見られた人もいたが、間
質性肺炎を発症し、死亡に至った人もいた。
○それらの副作用報告を受けて、国の指導のもと、製薬会社は販売から3か月後に添付
文書を改訂して間質性肺炎によって死亡する危険性があることがよりわかるように警
告するとともに、その改訂について医療従事者(医療機関)/薬局に緊急に伝達する
などの安全対策を行った。
○なお、こうした国や製薬企業の対応が不十分として国や製薬企業を相手に訴訟が提起
されたが、国や製薬企業の責任はないとされ、現在、イレッサは、抗がん剤として使
用されている。
~承認から市販後に至る経緯~
(注1)添付文書は副作用の重篤度等に応じて「警告」
、
「重大な副作用」
、
「その他の副作用」の順に記載されている
(注2)緊急安全性情報は、薬の添付文書の使用上の注意事項の改訂を行うもののうち重要かつ緊急な伝達が必要と判
断されるものについて、製薬企業から医療従事者(医療機関)/薬局に対して配布される
※なお、イレッサの事例からは、製薬会社の作成した薬の添付文書を踏まえ、死に至りう
る副作用を引き起こす可能性について、医療従事者が患者やその家族にきちんと説明をし
- 26 -
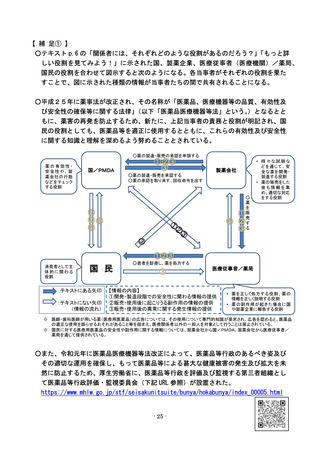
○医薬品をめぐり、社会問題化した最近の具体的な事例を基に、これまでに作られてきた
安全対策の仕組みがどのように機能しているか、他に考えるべき問題点はないか、見て
みよう。
【事例:販売名:イレッサ(一般名:ゲフィチニブ)に関する対応】
○イレッサは、肺がんを治療する錠剤タイプの飲み薬であり、点滴で投与し健康な細胞
にも作用してしまう従来の抗がん剤とは異なり、がん細胞を増殖させる特定の分子を
阻害する新タイプの薬である。肺がんに有効な治療薬がほとんどない中で、早期の承
認に向けた強い期待を集め、肺がんの治験での有効性や副作用情報などを踏まえて、
2002 年、世界に先駆けて日本で承認された。
○販売に当たっては、薬の用法・用量、使用上の注意などを記載した添付文書により、
間質性肺炎<肺の肺胞と肺胞の間の壁(間質)に炎症が起きることにより、肺での酸
素の取り込みが困難になり、呼吸困難や呼吸不全等を生じる病気>が起こりうること
を記載して注意喚起を行っていた。
○販売開始後、イレッサを服用することで腫瘍に対する効果が見られた人もいたが、間
質性肺炎を発症し、死亡に至った人もいた。
○それらの副作用報告を受けて、国の指導のもと、製薬会社は販売から3か月後に添付
文書を改訂して間質性肺炎によって死亡する危険性があることがよりわかるように警
告するとともに、その改訂について医療従事者(医療機関)/薬局に緊急に伝達する
などの安全対策を行った。
○なお、こうした国や製薬企業の対応が不十分として国や製薬企業を相手に訴訟が提起
されたが、国や製薬企業の責任はないとされ、現在、イレッサは、抗がん剤として使
用されている。
~承認から市販後に至る経緯~
(注1)添付文書は副作用の重篤度等に応じて「警告」
、
「重大な副作用」
、
「その他の副作用」の順に記載されている
(注2)緊急安全性情報は、薬の添付文書の使用上の注意事項の改訂を行うもののうち重要かつ緊急な伝達が必要と判
断されるものについて、製薬企業から医療従事者(医療機関)/薬局に対して配布される
※なお、イレッサの事例からは、製薬会社の作成した薬の添付文書を踏まえ、死に至りう
る副作用を引き起こす可能性について、医療従事者が患者やその家族にきちんと説明をし
- 26 -