よむ、つかう、まなぶ。
(参考資料3)業界からの要望事項 (48 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39786.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第1回 4/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
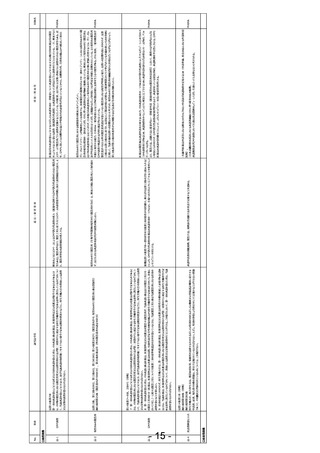
再生医療等製品は、既存治療では効果が得られず重篤な状態にある患者を対象とすること
が多く、これらの患者では、病状により再度細胞を採取して製造することができない、ある
いは再製造を待てない場合があります。規格外品であっても、細胞数がわずかに基準を下回
るなど、その内容によっては、患者個別のリスクベネフィット評価により期待されるベネフ
ィットがリスクを上回ると判断される場合があります。患者本人の細胞から製造された製
品が規格外品となり使用できない場合には、患者は唯一の治療選択肢が失われることとな
ります。このため、治療医師及び患者から規格外品であっても使用したいとの強い要望があ
る場合、各国の規制に沿って、人道的観点から患者の治療を目的として規格外品が提供され
ています。
現在、本邦においては、治験の枠組みにて、製造販売企業の任意で規格外品が提供されてい
ます。しかしながら、本来の治験の趣旨である「新しい医薬品等の承認のために必要な実証
データの収集を目的として実施する臨床試験」とは異なる人道的な提供であるにもかかわ
らず、治験として実施するために、医療現場や製造販売企業には、GCP に準拠した治験実
施体制の構築及び維持管理、治験審査委員会における審査対応、安全性及び有効性データの
収集及び評価等の負担が、規格外品を提供・使用するためにかかっています。また、臨床現
場では、同一製品の同一適応症で市販対応と治験対応との二つの運用が混在することとな
り、人為的なエラーが起きるリスクの高い状況となっています。当該治験は製品が市場で使
用される限り終わりがなく、治療の普及や製品数の増加に伴って医療現場と製造販売企業
の負荷は高まる一方であり、人道的観点からの規格外品の提供は持続可能な体制ではあり
ません。
欧米においては、規制当局の管理の下、規格外品を用いた治療への患者のアクセスを許容す
る枠組みが存在します。とりわけ EU では、細胞・組織からなる先端医療医薬品(ATMP)
の特性を踏まえて、ATMP に対する GMP ガイドラインにて、致死的で重篤な疾患あるい
は状態にあり治療選択肢のない患者に、治療を目的とした規格外品の例外的な提供を認め
ています。提供に先立ち、製造販売企業は規格外品個別にリスク評価を行い、その評価結果
を医師に提供しています。医師は、規格外品のリスク評価結果と患者個別のリスクベネフィ
ット評価を踏まえて規格外品の投与が医学的に必要であり、患者が規格外品の投与を希望
することを確認しています。また、欧米の細胞治療レジストリでは、規格外品の使用に関す
る情報が収集されており、公表されているリアルワールドエビデンスでは、規格外品の有効
性及び安全性は規格を満たしている通常の市販製品と同様である旨が報告されています。
ついては、EU における人道的提供の枠組みも参考にして、患者の治療を目的とした規格外
品の提供に関する持続可能な仕組みづくりのために、早期の法改正を要望いたします。
以上
2
- 47 -
が多く、これらの患者では、病状により再度細胞を採取して製造することができない、ある
いは再製造を待てない場合があります。規格外品であっても、細胞数がわずかに基準を下回
るなど、その内容によっては、患者個別のリスクベネフィット評価により期待されるベネフ
ィットがリスクを上回ると判断される場合があります。患者本人の細胞から製造された製
品が規格外品となり使用できない場合には、患者は唯一の治療選択肢が失われることとな
ります。このため、治療医師及び患者から規格外品であっても使用したいとの強い要望があ
る場合、各国の規制に沿って、人道的観点から患者の治療を目的として規格外品が提供され
ています。
現在、本邦においては、治験の枠組みにて、製造販売企業の任意で規格外品が提供されてい
ます。しかしながら、本来の治験の趣旨である「新しい医薬品等の承認のために必要な実証
データの収集を目的として実施する臨床試験」とは異なる人道的な提供であるにもかかわ
らず、治験として実施するために、医療現場や製造販売企業には、GCP に準拠した治験実
施体制の構築及び維持管理、治験審査委員会における審査対応、安全性及び有効性データの
収集及び評価等の負担が、規格外品を提供・使用するためにかかっています。また、臨床現
場では、同一製品の同一適応症で市販対応と治験対応との二つの運用が混在することとな
り、人為的なエラーが起きるリスクの高い状況となっています。当該治験は製品が市場で使
用される限り終わりがなく、治療の普及や製品数の増加に伴って医療現場と製造販売企業
の負荷は高まる一方であり、人道的観点からの規格外品の提供は持続可能な体制ではあり
ません。
欧米においては、規制当局の管理の下、規格外品を用いた治療への患者のアクセスを許容す
る枠組みが存在します。とりわけ EU では、細胞・組織からなる先端医療医薬品(ATMP)
の特性を踏まえて、ATMP に対する GMP ガイドラインにて、致死的で重篤な疾患あるい
は状態にあり治療選択肢のない患者に、治療を目的とした規格外品の例外的な提供を認め
ています。提供に先立ち、製造販売企業は規格外品個別にリスク評価を行い、その評価結果
を医師に提供しています。医師は、規格外品のリスク評価結果と患者個別のリスクベネフィ
ット評価を踏まえて規格外品の投与が医学的に必要であり、患者が規格外品の投与を希望
することを確認しています。また、欧米の細胞治療レジストリでは、規格外品の使用に関す
る情報が収集されており、公表されているリアルワールドエビデンスでは、規格外品の有効
性及び安全性は規格を満たしている通常の市販製品と同様である旨が報告されています。
ついては、EU における人道的提供の枠組みも参考にして、患者の治療を目的とした規格外
品の提供に関する持続可能な仕組みづくりのために、早期の法改正を要望いたします。
以上
2
- 47 -