よむ、つかう、まなぶ。
資料5-2 令和5年度医薬品等自主回収一覧[1.7MB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
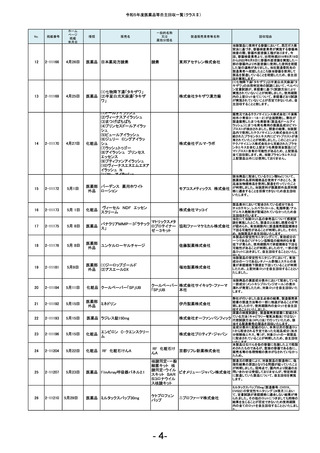
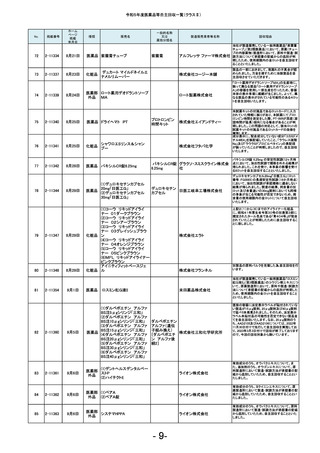
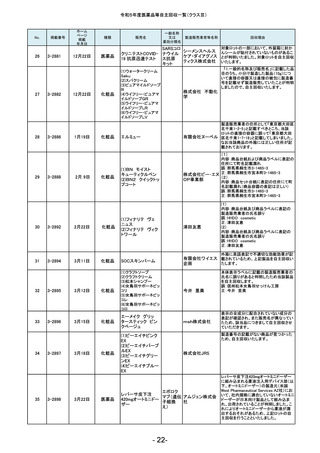
令和5年度医薬品等自主回収一覧(クラスⅡ)
No.
181
掲載番号
2-11607
ホーム
ページ
掲載
年月日
2月20日
種類
医薬品
販売名
2-11608
2月 20日
医薬品 ケミルミ EPO
183
2-11618
2月28日
化粧品
2-11621
2月29日
医薬品 ルミパルスプレスト HCV
2-11623
2月29日
医薬品 オメプラゾン錠20mg
186
2-11624
3月1日
医薬品 シェルガン0.5眼粘弾剤
2-11625
3月4日
188
2-11626
3月5日
エリスロポエチ
ンキット
ドゥーオーガニック クレンジ
ング ミルク
185
187
製造販売業者等名称
ケトチフェンフマ
ケトチフェンDS小児用0.1%
ル酸塩ドライシ 沢井製薬株式会社
「サワイ」
ロップ
182
184
一般的名称
又は
薬効分類名
C型肝炎ウイル
富士レビオ株式会社
ス抗体キット
医薬品 Myoglobin・アボット
田辺三菱製薬株式会社
生化学工業株式会社
(1)防風通聖散料エキス錠
「至聖」
(2)防風通聖散料エキス錠
「創至聖」
医薬品 (3)NID防風通聖散錠Z600
0
(4)ビタトレール防風通聖散
EX錠
ミオグロビン
キット
アボットジャパン合同会社
2-11628
3月6日
医薬品 若甦錠S
190
2-11630
3月7日
医薬品
オロパタジン塩酸塩錠5mg
「トーワ」
オロパタジン塩
酸塩
191
2-11632
3月8日
医薬品
タイタンジェル CK
クレアチンキ
ナーゼアイソザ 株式会社ヘレナ研究所
イムキット
192
2-11637
3月13日
医薬品 ジメチコン内用液2%「FSK」
2-11638
3月13日
当該製品の対象ロットの市場出荷品の一部に乳
化状態が崩れることが確認されました。化粧品と
して製品の性格上、分離する可能性のあるもの
は好ましくないと判断し、自主回収いたします。
対象ロットにおいて、HCV用標準陰性溶液のカウ
ントが高値化し、装置に設定のカウント上限値を
超えることによるキャリブレーション不成立が発
生しているため。
本製品の安定性モニタリングにおいて、溶出率
が規格を満たさない錠剤が含まれていることが
判明しました。そのため、このような錠剤が含ま
れる可能性を否定できない製品2ロットを自主回
収することとしました。
本製品の充填工程において、承認書上の工程管
理試験である充填重量を排出重量をもって管理
しておりましたが、判定基準の設定に不備があっ
たことが判明しました。すべてのロットは、製剤の
承認規格に適合することを確認しておりますが、
充填工程の工程管理基準を逸脱していたロット
につき、自主回収いたします。
原薬の製造所において、製造方法及び試験方法
について承認書の記載からの逸脱が判明したた
め、使用期限内の対象ロットを自主回収すること
といたしました。
北日本製薬株式会社
189
193
ケトチフェンDS小児用0.1%「サワイ」の分包包装
品(Lot.120401と121201)において、年次安定性モ
ニタリング36か月時点で、定量が承認規格に適
合しないことを確認しました。調査の結果、本剤
の分包包装品は、同様に使用期限内において定
量が承認規格に適合しない可能性が否定できな
いことから、本剤の分包包装品について使用期
限内の全ロットを回収することとしました。
対象ロットにおいて、WHOの第3次国際標準品と
比較した際にアッセイ測定範囲全体で平均35%の
負のバイアスが発生することを確認しました。 添
シーメンスヘルスケア・ダイアグ 付文書に記載の参考基準範囲を満たすことがで
ノスティクス株式会社
きないため、当該ロットの自主回収を実施いたし
ます。
ジャパン・オーガニック株式会
社
オメプラゾール
回収理由
日東薬品工業株式会社
東和薬品株式会社
株式会社伏見製薬所
(1)カルボプラチン点滴静注液
50mg「SW」
(2)カルボプラチン点滴静注液 カルボプラチン 沢井製薬株式会社 信頼性保
医薬品
150mg「SW」
注射液
証本部
(3)カルボプラチン点滴静注液
450mg「SW」
- 17-
製造元での調査の結果、対象ロットのマイクロ
パーティクルが、規定濃度を満たしてないことが
確認されたため、当該製品の自主回収を実施い
たします。
当該製品の一部の製造ロットにおいて、安定性
モニタリングの結果から、有効成分シアノコバラミ
ンの使用期限(36箇月時点)での予測値が承認
規格を下回る可能性のあることが確認されまし
た。そのため対象のロットを自主的に回収するこ
とといたしました。
B0421において、別ロットで使用するために調製
したフィルムコーティング液の一部を追加混入し
た可能性がありましたので、B0421を自主回収す
ることといたしました。
感度試験に使用する試料の活性を測定するキッ
トを国際単位系からJSCC標準化対応試薬に変
更した際に単位と表示値が変更になりましたが、
承認書の変更手続きを失念しておりました。承認
書に記載されている方法で感度試験を実施して
いないことが判明したため、使用期限内の上記
ロットを自主回収します。
本製品(製造番号11204F)の安定性モニタリング
24ヵ月時点の微生物限度試験おいて、承認規格
を超える微生物数が検出されました。調査の結
果、市場に流通している製品のうち、当該製造番
号と同じ製造ラインで本製品以前に製造された
使用期限内の製品(2021年4月~2021年12月製
造品)についての品質保証は難しいと判断し、自
主回収することといたしました。なお、本製品以
降の製品(2022年1月以降製造品)につきまして
は、対策を講じておりますので同様の事案が発
生するおそれはないと考えております。
カルボプラチン点滴静注液50mg「SW」の安定性
モニタリング24ヵ月時点において、不溶性異物が
確認されました。含量規格違いの150mg、450mg
製剤の同時期の安定性モニタリングでは不溶性
異物は認められていませんが、いずれの規格の
製剤も同一処方であり、充填量が異なるのみで
あることから、全ての含量規格の製剤において不
溶性異物が発生する可能性が否定できないた
め、上記製剤の使用期限内の全ロットを回収す
ることとしました。
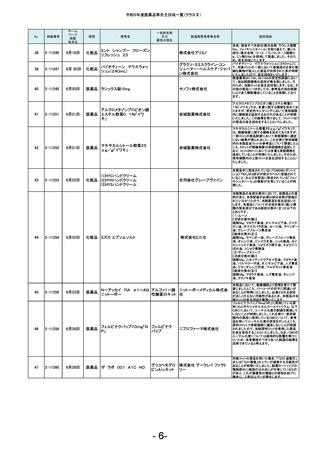
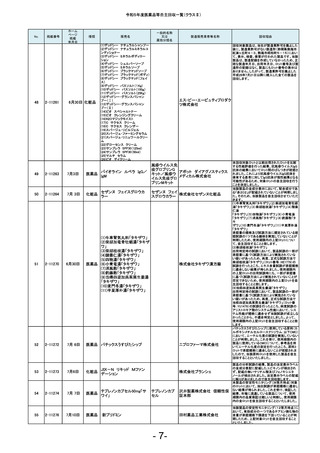
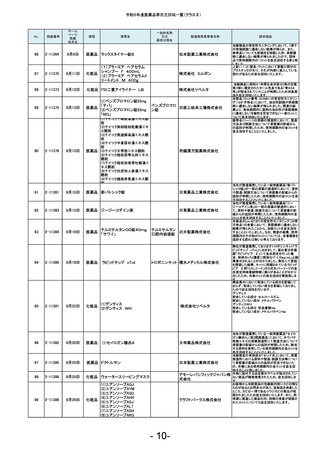
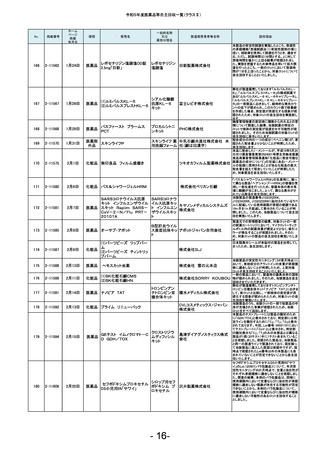
No.
181
掲載番号
2-11607
ホーム
ページ
掲載
年月日
2月20日
種類
医薬品
販売名
2-11608
2月 20日
医薬品 ケミルミ EPO
183
2-11618
2月28日
化粧品
2-11621
2月29日
医薬品 ルミパルスプレスト HCV
2-11623
2月29日
医薬品 オメプラゾン錠20mg
186
2-11624
3月1日
医薬品 シェルガン0.5眼粘弾剤
2-11625
3月4日
188
2-11626
3月5日
エリスロポエチ
ンキット
ドゥーオーガニック クレンジ
ング ミルク
185
187
製造販売業者等名称
ケトチフェンフマ
ケトチフェンDS小児用0.1%
ル酸塩ドライシ 沢井製薬株式会社
「サワイ」
ロップ
182
184
一般的名称
又は
薬効分類名
C型肝炎ウイル
富士レビオ株式会社
ス抗体キット
医薬品 Myoglobin・アボット
田辺三菱製薬株式会社
生化学工業株式会社
(1)防風通聖散料エキス錠
「至聖」
(2)防風通聖散料エキス錠
「創至聖」
医薬品 (3)NID防風通聖散錠Z600
0
(4)ビタトレール防風通聖散
EX錠
ミオグロビン
キット
アボットジャパン合同会社
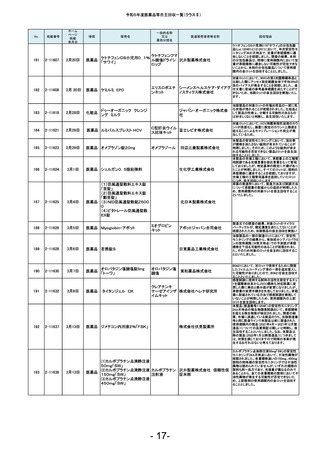
2-11628
3月6日
医薬品 若甦錠S
190
2-11630
3月7日
医薬品
オロパタジン塩酸塩錠5mg
「トーワ」
オロパタジン塩
酸塩
191
2-11632
3月8日
医薬品
タイタンジェル CK
クレアチンキ
ナーゼアイソザ 株式会社ヘレナ研究所
イムキット
192
2-11637
3月13日
医薬品 ジメチコン内用液2%「FSK」
2-11638
3月13日
当該製品の対象ロットの市場出荷品の一部に乳
化状態が崩れることが確認されました。化粧品と
して製品の性格上、分離する可能性のあるもの
は好ましくないと判断し、自主回収いたします。
対象ロットにおいて、HCV用標準陰性溶液のカウ
ントが高値化し、装置に設定のカウント上限値を
超えることによるキャリブレーション不成立が発
生しているため。
本製品の安定性モニタリングにおいて、溶出率
が規格を満たさない錠剤が含まれていることが
判明しました。そのため、このような錠剤が含ま
れる可能性を否定できない製品2ロットを自主回
収することとしました。
本製品の充填工程において、承認書上の工程管
理試験である充填重量を排出重量をもって管理
しておりましたが、判定基準の設定に不備があっ
たことが判明しました。すべてのロットは、製剤の
承認規格に適合することを確認しておりますが、
充填工程の工程管理基準を逸脱していたロット
につき、自主回収いたします。
原薬の製造所において、製造方法及び試験方法
について承認書の記載からの逸脱が判明したた
め、使用期限内の対象ロットを自主回収すること
といたしました。
北日本製薬株式会社
189
193
ケトチフェンDS小児用0.1%「サワイ」の分包包装
品(Lot.120401と121201)において、年次安定性モ
ニタリング36か月時点で、定量が承認規格に適
合しないことを確認しました。調査の結果、本剤
の分包包装品は、同様に使用期限内において定
量が承認規格に適合しない可能性が否定できな
いことから、本剤の分包包装品について使用期
限内の全ロットを回収することとしました。
対象ロットにおいて、WHOの第3次国際標準品と
比較した際にアッセイ測定範囲全体で平均35%の
負のバイアスが発生することを確認しました。 添
シーメンスヘルスケア・ダイアグ 付文書に記載の参考基準範囲を満たすことがで
ノスティクス株式会社
きないため、当該ロットの自主回収を実施いたし
ます。
ジャパン・オーガニック株式会
社
オメプラゾール
回収理由
日東薬品工業株式会社
東和薬品株式会社
株式会社伏見製薬所
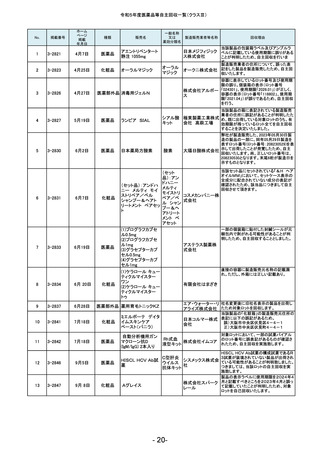
(1)カルボプラチン点滴静注液
50mg「SW」
(2)カルボプラチン点滴静注液 カルボプラチン 沢井製薬株式会社 信頼性保
医薬品
150mg「SW」
注射液
証本部
(3)カルボプラチン点滴静注液
450mg「SW」
- 17-
製造元での調査の結果、対象ロットのマイクロ
パーティクルが、規定濃度を満たしてないことが
確認されたため、当該製品の自主回収を実施い
たします。
当該製品の一部の製造ロットにおいて、安定性
モニタリングの結果から、有効成分シアノコバラミ
ンの使用期限(36箇月時点)での予測値が承認
規格を下回る可能性のあることが確認されまし
た。そのため対象のロットを自主的に回収するこ
とといたしました。
B0421において、別ロットで使用するために調製
したフィルムコーティング液の一部を追加混入し
た可能性がありましたので、B0421を自主回収す
ることといたしました。
感度試験に使用する試料の活性を測定するキッ
トを国際単位系からJSCC標準化対応試薬に変
更した際に単位と表示値が変更になりましたが、
承認書の変更手続きを失念しておりました。承認
書に記載されている方法で感度試験を実施して
いないことが判明したため、使用期限内の上記
ロットを自主回収します。
本製品(製造番号11204F)の安定性モニタリング
24ヵ月時点の微生物限度試験おいて、承認規格
を超える微生物数が検出されました。調査の結
果、市場に流通している製品のうち、当該製造番
号と同じ製造ラインで本製品以前に製造された
使用期限内の製品(2021年4月~2021年12月製
造品)についての品質保証は難しいと判断し、自
主回収することといたしました。なお、本製品以
降の製品(2022年1月以降製造品)につきまして
は、対策を講じておりますので同様の事案が発
生するおそれはないと考えております。
カルボプラチン点滴静注液50mg「SW」の安定性
モニタリング24ヵ月時点において、不溶性異物が
確認されました。含量規格違いの150mg、450mg
製剤の同時期の安定性モニタリングでは不溶性
異物は認められていませんが、いずれの規格の
製剤も同一処方であり、充填量が異なるのみで
あることから、全ての含量規格の製剤において不
溶性異物が発生する可能性が否定できないた
め、上記製剤の使用期限内の全ロットを回収す
ることとしました。