よむ、つかう、まなぶ。
資料7 先進医療合同会議の審議結果について【報告事項】 (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25067.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第132回 4/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
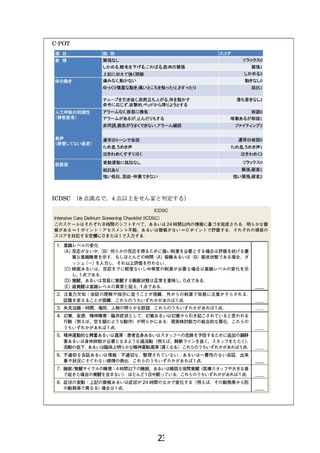
【別添5】
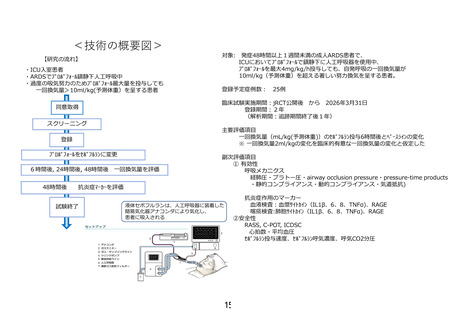
「人工呼吸管理を要する ARDS(急性呼吸促迫症候群)患者に対するセ
ボフルラン鎮静療法」の予定の試験期間及び症例数(申請書類より抜
粋)
7-2.予定の試験期間及び症例数
予定試験期間:jRCT への公表日 ~ 2026 年 3 月 31 日
登録期間:2 年
解析期間:観察期間終了後 1 年
予定症例数:25 例
既に実績のある症例数:0 例
予定試験期間及び予定症例数の設定根拠
本研究に対象患者は少なくとも 1 月に 1 名以上の割合で発生する、予定症例数は 25 例で
あるため、研究の遂行は 2 年以内に終了する予定である。観察終了後 1 年以内に、総括報
告書及び総括報告書の概要を提出する予定である。
一回換気量 2ml/kg の変化を臨床的有意な一回換気量の変化と仮定した。プロポフォー
ル投与終了時とセボフルラン投与 6 時間後との一回換気量の差の標準偏差を 3ml/kg、
Power 0.8, α=0.05 と仮定すると、21 例の患者集積を必要とする。研究の脱落率を 16%と
仮定し、予定症例数を 25 例とした。
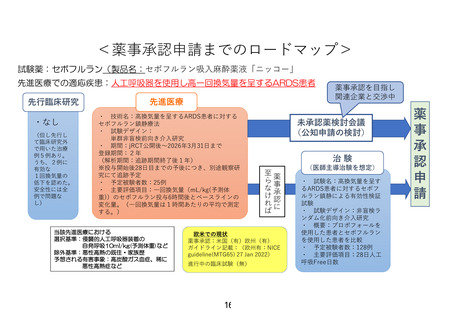
先行研究を免除される特例を用いた先進医療 B としての実施
本研究は、先進医療 B として実施する。研究責任医師は、開始当初の 3 例について、一例
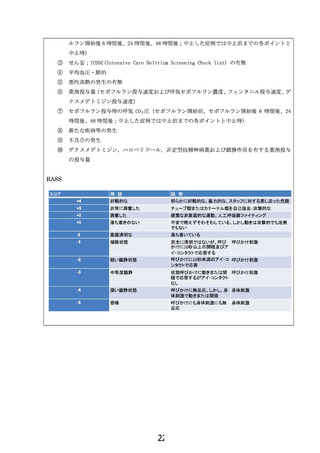
ずつ 6.2.2 に記載の安全性評価項目(速報)を確認して独立データモニタリング委員会
(IDMC)に報告し、研究継続の可否について審議を依頼する。研究責任医師は、IDMC の
審議結果により研究継続が妥当と判断された場合、先進医療技術審査部会に研究継続の可
否を諮り、承認が得られたのちに、引き続き症例登録を行い、研究を継続する。IDMC の
審議結果により研究計画の変更あるいは中止が妥当と判断された場合、研究責任医師は、
IDMC および CRB の審議結果に基づいて、本研究の継続の可否を判断する。
24
「人工呼吸管理を要する ARDS(急性呼吸促迫症候群)患者に対するセ
ボフルラン鎮静療法」の予定の試験期間及び症例数(申請書類より抜
粋)
7-2.予定の試験期間及び症例数
予定試験期間:jRCT への公表日 ~ 2026 年 3 月 31 日
登録期間:2 年
解析期間:観察期間終了後 1 年
予定症例数:25 例
既に実績のある症例数:0 例
予定試験期間及び予定症例数の設定根拠
本研究に対象患者は少なくとも 1 月に 1 名以上の割合で発生する、予定症例数は 25 例で
あるため、研究の遂行は 2 年以内に終了する予定である。観察終了後 1 年以内に、総括報
告書及び総括報告書の概要を提出する予定である。
一回換気量 2ml/kg の変化を臨床的有意な一回換気量の変化と仮定した。プロポフォー
ル投与終了時とセボフルラン投与 6 時間後との一回換気量の差の標準偏差を 3ml/kg、
Power 0.8, α=0.05 と仮定すると、21 例の患者集積を必要とする。研究の脱落率を 16%と
仮定し、予定症例数を 25 例とした。
先行研究を免除される特例を用いた先進医療 B としての実施
本研究は、先進医療 B として実施する。研究責任医師は、開始当初の 3 例について、一例
ずつ 6.2.2 に記載の安全性評価項目(速報)を確認して独立データモニタリング委員会
(IDMC)に報告し、研究継続の可否について審議を依頼する。研究責任医師は、IDMC の
審議結果により研究継続が妥当と判断された場合、先進医療技術審査部会に研究継続の可
否を諮り、承認が得られたのちに、引き続き症例登録を行い、研究を継続する。IDMC の
審議結果により研究計画の変更あるいは中止が妥当と判断された場合、研究責任医師は、
IDMC および CRB の審議結果に基づいて、本研究の継続の可否を判断する。
24