よむ、つかう、まなぶ。
総-5-5○最適使用推進ガイドラインについて (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00173.html |
| 出典情報 | 中央社会保険医療協議会 総会(第536回 1/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【安全性】
3.5.
海外第 I 相試験(017001 試験)
DLBCL コホートにおいて本品が投与された 269 名において、有害事象は 267 名(99.3%)に認め
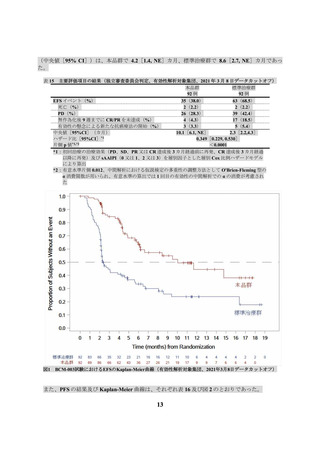
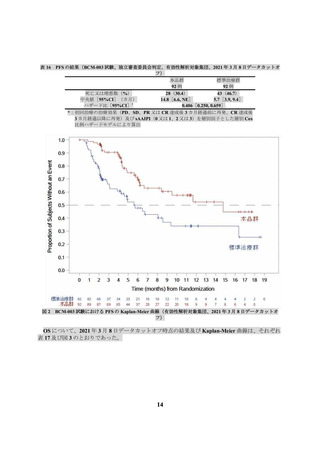
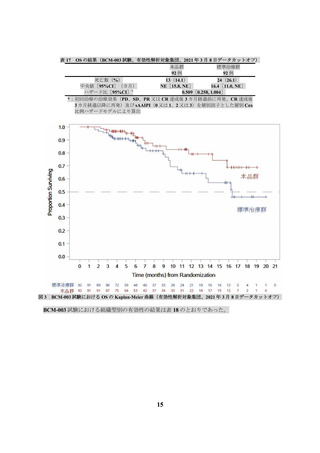
られ、副作用は 201 名(74.7%)に認められた(データカットオフ日:2019 年 8 月 12 日)。全グレ
ードの発現割合が 5%以上の副作用は表 19 のとおりであった。
表 19 全グレードの発現割合が 5%以上の副作用(017001 試験、データカットオフ日:2019 年 8 月 12 日)
患者数 (%)
N=269
器官別大分類
基本語
(MedDRA/J Ver. 21.0)
全副作用
免疫系障害
サイトカイン放出症候群
低γグロブリン血症
神経系障害
頭痛
振戦
浮動性めまい
失語症
脳症
一般・全身障害および投与部位の状態
疲労
発熱
血液およびリンパ系障害
好中球減少症
貧血
血小板減少症
発熱性好中球減少症
精神障害
錯乱状態
胃腸障害
悪心
心臓障害
洞性頻脈
血管障害
低血圧
代謝および栄養障害
食欲減退
CTCAE ver. 4.03
全グレード
201 ( 74.7)
グレード 3 以上
93 ( 34.6)
113 ( 42.0)
22 ( 8.2)
6 ( 2.2)
0
36 ( 13.4)
30 ( 11.2)
26 ( 9.7)
22 ( 8.3)
17 ( 6.3)
2 ( 0.7)
0
1 ( 0.4)
3 ( 1.1)
11 ( 4.1)
48 ( 17.8)
19 ( 7.1)
1 ( 0.4)
0
44 ( 16.4)
37 ( 13.8)
31 ( 11.5)
14 ( 5.2)
43 ( 16.0)
28 ( 10.4)
27 ( 10.0)
13 ( 4.8)
31 ( 11.5)
2 ( 0.7)
15 ( 5.6)
0
20 ( 7.4)
0
28 ( 10.4)
4 ( 1.5)
16 ( 5.9)
1 ( 0.4)
本品の投与期間中及び投与後から 30 日以内の死亡は、3 例に認められた。死因は、びまん性肺胞
障害、敗血症性ショック、心筋症が各 1 例であった。このうち、びまん性肺胞障害及び心筋症の各 1
例は、本品との因果関係が否定されなかった。その他、最終投与後 30 日目までに病勢進行により 6
例が死亡した。また、本品の最終投与後 31 日目以降の有害事象による死亡は、8/269 例(3.0%)に
認められた。死因は、進行性多巣性白質脳症が 2 例、肺出血、多臓器機能不全症候群、白質脳症、
骨髄異形成症候群、敗血症性ショック及び死亡が各 1 例であった。このうち、進行性多巣性白質脳
症、肺出血、多臓器機能不全症候群の各 1 例は、本品との因果関係が否定されなかった。その他、
最終投与後 31 日目以降に、病勢進行により 99 例が、その他の原因により 3 例(試験と関連のない
17
3.5.
海外第 I 相試験(017001 試験)
DLBCL コホートにおいて本品が投与された 269 名において、有害事象は 267 名(99.3%)に認め
られ、副作用は 201 名(74.7%)に認められた(データカットオフ日:2019 年 8 月 12 日)。全グレ
ードの発現割合が 5%以上の副作用は表 19 のとおりであった。
表 19 全グレードの発現割合が 5%以上の副作用(017001 試験、データカットオフ日:2019 年 8 月 12 日)
患者数 (%)
N=269
器官別大分類
基本語
(MedDRA/J Ver. 21.0)
全副作用
免疫系障害
サイトカイン放出症候群
低γグロブリン血症
神経系障害
頭痛
振戦
浮動性めまい
失語症
脳症
一般・全身障害および投与部位の状態
疲労
発熱
血液およびリンパ系障害
好中球減少症
貧血
血小板減少症
発熱性好中球減少症
精神障害
錯乱状態
胃腸障害
悪心
心臓障害
洞性頻脈
血管障害
低血圧
代謝および栄養障害
食欲減退
CTCAE ver. 4.03
全グレード
201 ( 74.7)
グレード 3 以上
93 ( 34.6)
113 ( 42.0)
22 ( 8.2)
6 ( 2.2)
0
36 ( 13.4)
30 ( 11.2)
26 ( 9.7)
22 ( 8.3)
17 ( 6.3)
2 ( 0.7)
0
1 ( 0.4)
3 ( 1.1)
11 ( 4.1)
48 ( 17.8)
19 ( 7.1)
1 ( 0.4)
0
44 ( 16.4)
37 ( 13.8)
31 ( 11.5)
14 ( 5.2)
43 ( 16.0)
28 ( 10.4)
27 ( 10.0)
13 ( 4.8)
31 ( 11.5)
2 ( 0.7)
15 ( 5.6)
0
20 ( 7.4)
0
28 ( 10.4)
4 ( 1.5)
16 ( 5.9)
1 ( 0.4)
本品の投与期間中及び投与後から 30 日以内の死亡は、3 例に認められた。死因は、びまん性肺胞
障害、敗血症性ショック、心筋症が各 1 例であった。このうち、びまん性肺胞障害及び心筋症の各 1
例は、本品との因果関係が否定されなかった。その他、最終投与後 30 日目までに病勢進行により 6
例が死亡した。また、本品の最終投与後 31 日目以降の有害事象による死亡は、8/269 例(3.0%)に
認められた。死因は、進行性多巣性白質脳症が 2 例、肺出血、多臓器機能不全症候群、白質脳症、
骨髄異形成症候群、敗血症性ショック及び死亡が各 1 例であった。このうち、進行性多巣性白質脳
症、肺出血、多臓器機能不全症候群の各 1 例は、本品との因果関係が否定されなかった。その他、
最終投与後 31 日目以降に、病勢進行により 99 例が、その他の原因により 3 例(試験と関連のない
17