よむ、つかう、まなぶ。
総-5-5○最適使用推進ガイドラインについて (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00173.html |
| 出典情報 | 中央社会保険医療協議会 総会(第536回 1/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
全奏効
割合
CR
割合
[95%
[59.2,
CIa]
75.8]
CR
64
n(%)
(48.9)
[95%
[40.0,
CIa]
57.7]
a:Clopper-Pearson 法
*:形質転換濾胞性リンパ腫
[57.7,
88.9]
20
(60.6)
[42.1,
77.1]
[72.1,
92.5]
36
(63.2)
[49.3,
75.6]
[35.7,
82.7]
7
(38.9)
[17.3,
64.3]
[9.4,
99.2]
2
(66.7)
[9.4,
99.2]
[49.2,
95.3]
7
(50.0)
[23.0,
77.0]
[66.8,
78.0]
136
(53.1)
[46.8,
59.4]
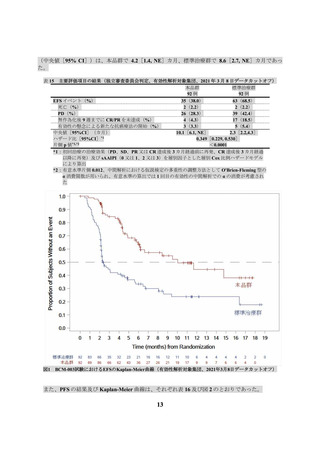
3.2.
国際共同第Ⅱ相試験(JCAR017-BCM-001 試験)(BCM-001 試験)
再発又は難治性のアグレッシブ B 細胞性 NHL 患者を対象に、本品の有効性及び安全性の検討を目
的とした非盲検非対照国際共同第Ⅱ相試験(以下、「BCM-001」という)が実施された。主な選
択・除外基準は、表 5 のとおりであった。
表 5 主な選択・除外基準
<選択基準>
再発又は難治性の以下のいずれかの組織型の B 細胞性 NHL を有する患者。
コホート 1:WHO 分類(2016 年)(Blood 2016; 127: 2375-90)に基づき、DLBCL*1、DLBCL の形態
を示す MYC 及び BCL2 又は BCL6 の両方か一方の遺伝子再構成を有する HGBCL もしくは FL3B と診
断され、アントラサイクリン系薬剤及びリツキシマブ(又は他の CD20 標的薬)を含む 2 レジメン以上
の化学療法を受けた患者。
コホート 2:WHO 分類(2016 年)(Blood 2016; 127: 2375-90)に基づき、DLBCL*1 又は DLBCL の形
態を示す MYC 及び BCL2 又は BCL6 の両方か一方の遺伝子再構成を有する HGBCL もしくは FL3B と
診断され、アントラサイクリン系薬剤及びリツキシマブ(又は他の CD20 標的薬)を含む 1 レジメンの
化学療法を受けた自家 HSCT 不適応の患者。
コホート 3(日本のみ):コホート 1 又は 2 の適格性基準を満たす患者。
直近の再発で組織学的に診断が確認されている患者。
ECOG PS が 0 又は 1 の患者*2。
<除外基準>
過去に CD19 標的療法を受けた患者。過去に HSCT を受けた患者(コホート 2 のみ)。
T 細胞/組織球豊富大細胞型 B 細胞リンパ腫(以下、「THRLBCL」という)、原発性皮膚大細胞型 B 細胞
リンパ腫、PMBCL、加齢性 EBV 陽性 DLBCL 及びバーキットリンパ腫を有する患者。
*1:de novo 又は形質転換濾胞性リンパ腫(以下、「tFL」という)
*2:治験実施計画書第 2 版の改訂で、ECOG PS スコアが 2 の患者は、年齢、全身状態又は併存疾患により高用量
化学療法及び自家 HSCT に不適応で、他の全ての選択/除外基準に適合している場合のみコホート 2 及び 3 の
みに登録可能に変更された。
本品の用法及び用量又は使用方法は、抗 CD19 CAR T 細胞として CD8 陽性 T 細胞及び CD4 陽性
T 細胞の投与細胞数の合計が 100×106 個となるよう、CD8 陽性 T 細胞(50×106 個)を静脈投与し
た後に CD4 陽性 T 細胞(50×106 個)が静脈内投与することとされた。
生体内での本品の生着と増殖を促進することを目的として、前処置として以下の LD 化学療法を
行い、LD 化学療法の終了から 2~7 日後に本品を投与することとされた。また、本品の製造期間中
に病勢コントロールのための抗がん治療(ブリッジング化学療法)が許容された。ブリッジング化
学療法は、低用量の抗がん剤(1 日あたり 300 mg/m2 以下のシクロホスファミド等)を使用すること
とされ、LD 化学療法の開始日より 7 日前までに完了することとされた。
(1)前処置の LD 化学療法
シクロホスファミド 300 mg/m2 及びフルダラビン 30 mg/m2 をいずれも 1 日 1 回、3 日間点滴静脈
内投与。また、患者の状態(腎機能障害等)に応じてフルダラビン及び/又はシクロホスファミドの
投与量の減量が行われた。なお、3 日間の LD 化学療法実施中に継続を妨げる有害事象が発現した場
合はフルダラビン及び/又はシクロホスファミドの投与量を減量又は投与が中止された。
7
割合
CR
割合
[95%
[59.2,
CIa]
75.8]
CR
64
n(%)
(48.9)
[95%
[40.0,
CIa]
57.7]
a:Clopper-Pearson 法
*:形質転換濾胞性リンパ腫
[57.7,
88.9]
20
(60.6)
[42.1,
77.1]
[72.1,
92.5]
36
(63.2)
[49.3,
75.6]
[35.7,
82.7]
7
(38.9)
[17.3,
64.3]
[9.4,
99.2]
2
(66.7)
[9.4,
99.2]
[49.2,
95.3]
7
(50.0)
[23.0,
77.0]
[66.8,
78.0]
136
(53.1)
[46.8,
59.4]
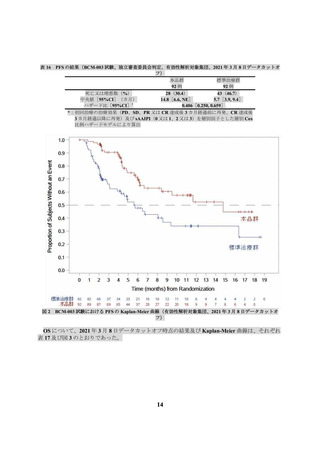
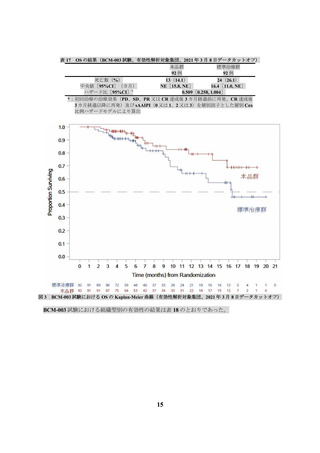
3.2.
国際共同第Ⅱ相試験(JCAR017-BCM-001 試験)(BCM-001 試験)
再発又は難治性のアグレッシブ B 細胞性 NHL 患者を対象に、本品の有効性及び安全性の検討を目
的とした非盲検非対照国際共同第Ⅱ相試験(以下、「BCM-001」という)が実施された。主な選
択・除外基準は、表 5 のとおりであった。
表 5 主な選択・除外基準
<選択基準>
再発又は難治性の以下のいずれかの組織型の B 細胞性 NHL を有する患者。
コホート 1:WHO 分類(2016 年)(Blood 2016; 127: 2375-90)に基づき、DLBCL*1、DLBCL の形態
を示す MYC 及び BCL2 又は BCL6 の両方か一方の遺伝子再構成を有する HGBCL もしくは FL3B と診
断され、アントラサイクリン系薬剤及びリツキシマブ(又は他の CD20 標的薬)を含む 2 レジメン以上
の化学療法を受けた患者。
コホート 2:WHO 分類(2016 年)(Blood 2016; 127: 2375-90)に基づき、DLBCL*1 又は DLBCL の形
態を示す MYC 及び BCL2 又は BCL6 の両方か一方の遺伝子再構成を有する HGBCL もしくは FL3B と
診断され、アントラサイクリン系薬剤及びリツキシマブ(又は他の CD20 標的薬)を含む 1 レジメンの
化学療法を受けた自家 HSCT 不適応の患者。
コホート 3(日本のみ):コホート 1 又は 2 の適格性基準を満たす患者。
直近の再発で組織学的に診断が確認されている患者。
ECOG PS が 0 又は 1 の患者*2。
<除外基準>
過去に CD19 標的療法を受けた患者。過去に HSCT を受けた患者(コホート 2 のみ)。
T 細胞/組織球豊富大細胞型 B 細胞リンパ腫(以下、「THRLBCL」という)、原発性皮膚大細胞型 B 細胞
リンパ腫、PMBCL、加齢性 EBV 陽性 DLBCL 及びバーキットリンパ腫を有する患者。
*1:de novo 又は形質転換濾胞性リンパ腫(以下、「tFL」という)
*2:治験実施計画書第 2 版の改訂で、ECOG PS スコアが 2 の患者は、年齢、全身状態又は併存疾患により高用量
化学療法及び自家 HSCT に不適応で、他の全ての選択/除外基準に適合している場合のみコホート 2 及び 3 の
みに登録可能に変更された。
本品の用法及び用量又は使用方法は、抗 CD19 CAR T 細胞として CD8 陽性 T 細胞及び CD4 陽性
T 細胞の投与細胞数の合計が 100×106 個となるよう、CD8 陽性 T 細胞(50×106 個)を静脈投与し
た後に CD4 陽性 T 細胞(50×106 個)が静脈内投与することとされた。
生体内での本品の生着と増殖を促進することを目的として、前処置として以下の LD 化学療法を
行い、LD 化学療法の終了から 2~7 日後に本品を投与することとされた。また、本品の製造期間中
に病勢コントロールのための抗がん治療(ブリッジング化学療法)が許容された。ブリッジング化
学療法は、低用量の抗がん剤(1 日あたり 300 mg/m2 以下のシクロホスファミド等)を使用すること
とされ、LD 化学療法の開始日より 7 日前までに完了することとされた。
(1)前処置の LD 化学療法
シクロホスファミド 300 mg/m2 及びフルダラビン 30 mg/m2 をいずれも 1 日 1 回、3 日間点滴静脈
内投与。また、患者の状態(腎機能障害等)に応じてフルダラビン及び/又はシクロホスファミドの
投与量の減量が行われた。なお、3 日間の LD 化学療法実施中に継続を妨げる有害事象が発現した場
合はフルダラビン及び/又はシクロホスファミドの投与量を減量又は投与が中止された。
7