よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
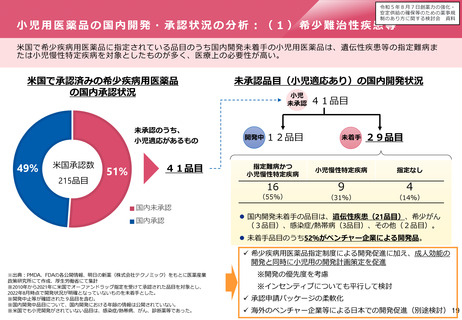
オーファン制度の日米欧比較
日本
米国
• 患者数50,000人未満又は指定
難病
• 医療上の必要性
• 開発の可能性
患者数200,000人未満又は米国に
おいて開発コストの回収が困難
優先審査
あり
ー
ー
手数料減免
あり
あり
あり
開発助成
医薬基盤・健康・栄養研究所に
よる助成事業
FDAによるOrphan Product Grant
Program
ECまたは他の団体による
税制優遇
あり
あり
ー
データ保護
再審査期間として10年
(通常8年)
7年(通常5年)
10年(通常8年)※
指定要件
優
遇
措
置
EU
• 有病率10,000人に5人以下
• 重篤又は慢性的衰弱
• 医療上の必要性
※通常の新薬が8年間のデータ保護+2年間の市場独占であるのに対し、オーファンは10年間のデータ
保護であるため、その間は後発医薬品の承認申請ができない。また、その対象は同種同効薬にも及ぶ。
12
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
オーファン制度の日米欧比較
日本
米国
• 患者数50,000人未満又は指定
難病
• 医療上の必要性
• 開発の可能性
患者数200,000人未満又は米国に
おいて開発コストの回収が困難
優先審査
あり
ー
ー
手数料減免
あり
あり
あり
開発助成
医薬基盤・健康・栄養研究所に
よる助成事業
FDAによるOrphan Product Grant
Program
ECまたは他の団体による
税制優遇
あり
あり
ー
データ保護
再審査期間として10年
(通常8年)
7年(通常5年)
10年(通常8年)※
指定要件
優
遇
措
置
EU
• 有病率10,000人に5人以下
• 重篤又は慢性的衰弱
• 医療上の必要性
※通常の新薬が8年間のデータ保護+2年間の市場独占であるのに対し、オーファンは10年間のデータ
保護であるため、その間は後発医薬品の承認申請ができない。また、その対象は同種同効薬にも及ぶ。
12