よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年10月13日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
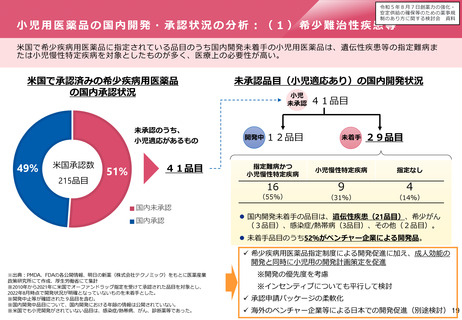
対応の方向性(中等度変更事項の導入)(案)
⚫ 医薬品の製造方法等の変更管理については、欧米と同様に、変更案を提出し、短期間の確認期間を経て変更を行
うことができる新たな変更カテゴリとして「中等度変更事項」を導入することとしてはどうか。
⚫ 制度の詳細やフィージビリティを検討するため、まずは対象を限定して試行的に導入してはどうか。
⚫ 試行における「中等度変更事項」の対象については、変更内容のリスクの程度に基づき、①初回承認申請又は一
変申請の審査においてあらかじめ「中等度変更事項」として特定された事項、及び②変更が生じた都度のPMDA相
談で中等度変更事項への該当性を確認された事項としてはどうか。
⚫ また、試行においての「中等度変更事項」に係る薬事手続は、現行の一変申請の一類型とした上で、その審査を
短期間で実施することとしてはどうか。
⚫ 試行的実施の方法、その結果を踏まえたその後の制度のあり方を含め、具体的な制度設計については、今後、国
際整合性を踏まえながら、製薬業界・行政間で引き続き議論していくこととしてはどうか。
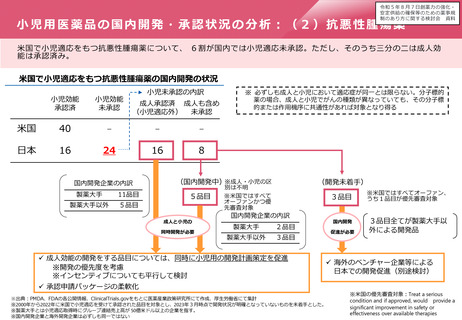
中等度変更事項の審査制度の試行イメージ
対
象
を
限
定
し
て
試
行
事前に新規申請・一変申請等にお
いて「中等度変更事項」を特定
一変申請の一類型
事前に特定されていない事項※に
ついては、PMDA相談で中等度変
更事項への該当性を確認
※試行においては、主に、欧米でCBE 30又は
Type IB申請が予定されている対象を想定
「中等度変更
事項」に係る
一変申請
PMDAによる審査
承認
変更実装
審査期間は短期間を目標とする。
欧米と同様に[受理までの期間+30営業日]程度の方向で検討。
ただし、確認中に照会事項が発生した場合は、この限りではない。
35
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
対応の方向性(中等度変更事項の導入)(案)
⚫ 医薬品の製造方法等の変更管理については、欧米と同様に、変更案を提出し、短期間の確認期間を経て変更を行
うことができる新たな変更カテゴリとして「中等度変更事項」を導入することとしてはどうか。
⚫ 制度の詳細やフィージビリティを検討するため、まずは対象を限定して試行的に導入してはどうか。
⚫ 試行における「中等度変更事項」の対象については、変更内容のリスクの程度に基づき、①初回承認申請又は一
変申請の審査においてあらかじめ「中等度変更事項」として特定された事項、及び②変更が生じた都度のPMDA相
談で中等度変更事項への該当性を確認された事項としてはどうか。
⚫ また、試行においての「中等度変更事項」に係る薬事手続は、現行の一変申請の一類型とした上で、その審査を
短期間で実施することとしてはどうか。
⚫ 試行的実施の方法、その結果を踏まえたその後の制度のあり方を含め、具体的な制度設計については、今後、国
際整合性を踏まえながら、製薬業界・行政間で引き続き議論していくこととしてはどうか。
中等度変更事項の審査制度の試行イメージ
対
象
を
限
定
し
て
試
行
事前に新規申請・一変申請等にお
いて「中等度変更事項」を特定
一変申請の一類型
事前に特定されていない事項※に
ついては、PMDA相談で中等度変
更事項への該当性を確認
※試行においては、主に、欧米でCBE 30又は
Type IB申請が予定されている対象を想定
「中等度変更
事項」に係る
一変申請
PMDAによる審査
承認
変更実装
審査期間は短期間を目標とする。
欧米と同様に[受理までの期間+30営業日]程度の方向で検討。
ただし、確認中に照会事項が発生した場合は、この限りではない。
35