よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年11月15日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
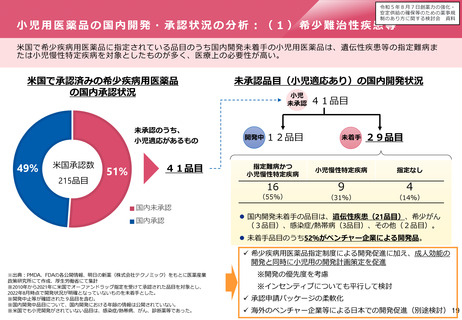
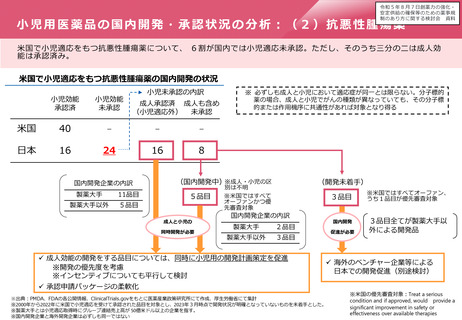
これまでのドラッグ・ラグ/ドラッグ・ロス対策
⚫ ドラッグ・ラグ対策として、国内開発における相談事業を充実させるとともに、世界最速規模の審査期間を目指し、PMDAの体制整備、
業務見直し等により、世界最速クラスの審査期間を達成。
⚫ また、医療上必要性の高い新医薬品の迅速な承認に向け、国民の要望を受けた医薬品について、「医療上の必要性の高い未承認薬・適
応外薬検討会議」を経て企業に対して開発要請又は開発公募。これに合わせ、欧米における承認状況をタイムリーに把握するため、未
承認薬データベースを作成・公表。
⚫ 他方、海外ベンチャー等が国内開発未着手の医薬品について自発的な活動を促す対策は積極的には行っていなかった。
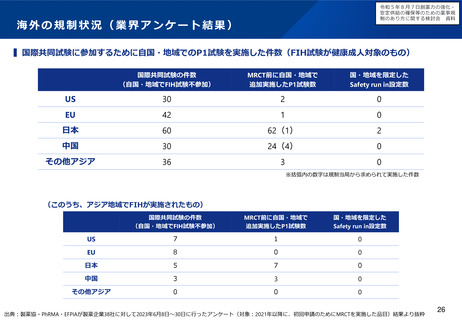
ドラッグ・ラグの試算
New active substance (NAS) median approval
time for six regulatory authorities in 2013-2022
【新有効成分含有医薬品】
© 2023 CIRS, R&D Briefing 88
800
平成29年度 平成30年度 令和元年度 令和2年度 令和3年度
EUROPE
CANADA
USA
SWITZERLAND
JAPAN
AUSTRALIA
開発ラグ
0.2年
0.7年
0.5年
0.5年
0.3年
600
審査ラグ
0.2年
0.2年
0.1年
0.2年
0.1年
400
351 (351)
ドラッ
グ・ラグ
0.4年
0.9年
0.6年
0.7年
0.4年
200
347 (347)
334 (334)
322 (275)
(注)
開発ラグ
:
当該年度に国内で新規承認申請された新薬について、米国にお
ける申請時期との差の中央値
審査ラグ
:
当該年度(米国は暦年)における日米間の新薬の新規承認され
た総審査期間(中央値)の差
FDAのNew Molecular Entity (NME) Drug and New Biologic Approvals
に掲載されている品目から総審査期間(中央値)を算出した値を使用
ドラッグ・ラグ:
開発ラグと審査ラグの和
430 (362)
418 (297)
PMDA:
322
0
2013 2014 2015 2016 2017 2018 2019 2020 2021 2022
Approval year
Approval time is calculated from the date of submission to the date of approval by the agency. This time
includes agency and company time. EMA approval time includes the EU Commission time. N1 = median
approval time for products approved in 2022; (N2) = median time from submission to the end of scientific
assessment for products approved in 2022.
※審査担当組織の審査期間を括弧内に記す。
〇未承認薬データベース(2009年4月~) https://www.pmda.go.jp/review-services/drug-reviews/review-information/p-drugs/0013.html
43
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
これまでのドラッグ・ラグ/ドラッグ・ロス対策
⚫ ドラッグ・ラグ対策として、国内開発における相談事業を充実させるとともに、世界最速規模の審査期間を目指し、PMDAの体制整備、
業務見直し等により、世界最速クラスの審査期間を達成。
⚫ また、医療上必要性の高い新医薬品の迅速な承認に向け、国民の要望を受けた医薬品について、「医療上の必要性の高い未承認薬・適
応外薬検討会議」を経て企業に対して開発要請又は開発公募。これに合わせ、欧米における承認状況をタイムリーに把握するため、未
承認薬データベースを作成・公表。
⚫ 他方、海外ベンチャー等が国内開発未着手の医薬品について自発的な活動を促す対策は積極的には行っていなかった。
ドラッグ・ラグの試算
New active substance (NAS) median approval
time for six regulatory authorities in 2013-2022
【新有効成分含有医薬品】
© 2023 CIRS, R&D Briefing 88
800
平成29年度 平成30年度 令和元年度 令和2年度 令和3年度
EUROPE
CANADA
USA
SWITZERLAND
JAPAN
AUSTRALIA
開発ラグ
0.2年
0.7年
0.5年
0.5年
0.3年
600
審査ラグ
0.2年
0.2年
0.1年
0.2年
0.1年
400
351 (351)
ドラッ
グ・ラグ
0.4年
0.9年
0.6年
0.7年
0.4年
200
347 (347)
334 (334)
322 (275)
(注)
開発ラグ
:
当該年度に国内で新規承認申請された新薬について、米国にお
ける申請時期との差の中央値
審査ラグ
:
当該年度(米国は暦年)における日米間の新薬の新規承認され
た総審査期間(中央値)の差
FDAのNew Molecular Entity (NME) Drug and New Biologic Approvals
に掲載されている品目から総審査期間(中央値)を算出した値を使用
ドラッグ・ラグ:
開発ラグと審査ラグの和
430 (362)
418 (297)
PMDA:
322
0
2013 2014 2015 2016 2017 2018 2019 2020 2021 2022
Approval year
Approval time is calculated from the date of submission to the date of approval by the agency. This time
includes agency and company time. EMA approval time includes the EU Commission time. N1 = median
approval time for products approved in 2022; (N2) = median time from submission to the end of scientific
assessment for products approved in 2022.
※審査担当組織の審査期間を括弧内に記す。
〇未承認薬データベース(2009年4月~) https://www.pmda.go.jp/review-services/drug-reviews/review-information/p-drugs/0013.html
43