よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
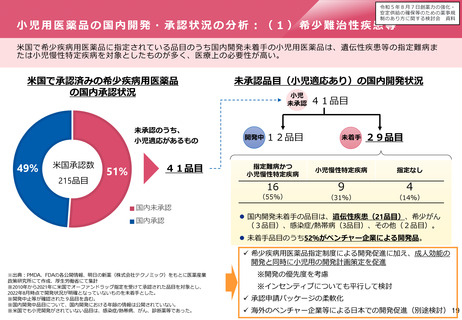
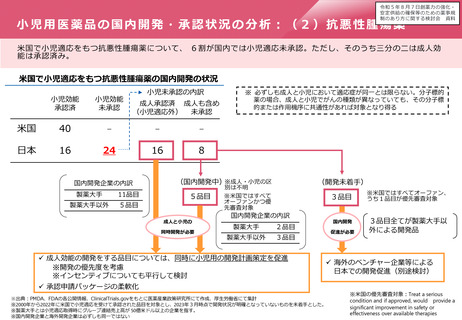
ドラッグ・ラグ/ドラッグ・ロスの実態
•
•
2023年3月時点において、欧米では承認されているが国内開発未着手の医薬品は86品目(未承認薬のうち60.1%)あ
り、そもそも承認申請がなされない(=企業が開発しない)というドラッグラグ・ロスが発生していると指摘されて
いる。
国内開発状況が未着手の86品目について傾向を分析したところ、ベンチャー発の医薬品や、オーファン、小児の割合
が比較的大きいことが分かった。
日欧米のドラッグラグ・ロスの状況
米国
欧州
承認済
未承認合計
136
7
86
57
日本国内未着手の品目内訳
未承認の内数 (品目数)
開発中
未着手
3
4
26
31
内訳
ベンチャー発
オーファン
小児
56
47
37
%
(48品目)
%
(40品目)
%
(32品目)
※ロス86品目のうち、ベンチャー、オーファン、小児のいずれでもない品目は14品目(16%)
日本
0
143
57
86
(品目)
※出典:PMDA、FDA、EMA の各公開情報、明日の新薬(株式会社テクノミック)をもとに医薬産業政策研究所にて作成、厚生労働省にて集計
※1:2016-2020年に欧米で承認されたNMEのうち、2022年末時点で日本では承認を受けていない品目を未承認として集計
※2:2023年3月時点で開発情報のない品目を国内開発の未着手として集計
※3:欧米の承認取得年が設立から30年以内で承認取得前年の売上が5億米ドル未満の開発企業をベンチャーとして集計
※4:欧米にてオーファンドラッグ指定を承認時までに受けた品目をオーファンとして集計
※5:2022年末時点で欧米で小児適応を取得した品目を小児として集計
•
•
2023年3月時点において、欧米では承認されているが国内開発未着手の医薬品は86品目(未承認薬のうち60.1%)あ
り、そもそも承認申請がなされない(=企業が開発しない)というドラッグラグ・ロスが発生していると指摘されて
いる。
国内開発状況が未着手の86品目について傾向を分析したところ、ベンチャー発の医薬品や、オーファン、小児の割合
が比較的大きいことが分かった。
日欧米のドラッグラグ・ロスの状況
米国
欧州
承認済
未承認合計
136
7
86
57
日本国内未着手の品目内訳
未承認の内数 (品目数)
開発中
未着手
3
4
26
31
内訳
ベンチャー発
オーファン
小児
56
47
37
%
(48品目)
%
(40品目)
%
(32品目)
※ロス86品目のうち、ベンチャー、オーファン、小児のいずれでもない品目は14品目(16%)
日本
0
143
57
86
(品目)
※出典:PMDA、FDA、EMA の各公開情報、明日の新薬(株式会社テクノミック)をもとに医薬産業政策研究所にて作成、厚生労働省にて集計
※1:2016-2020年に欧米で承認されたNMEのうち、2022年末時点で日本では承認を受けていない品目を未承認として集計
※2:2023年3月時点で開発情報のない品目を国内開発の未着手として集計
※3:欧米の承認取得年が設立から30年以内で承認取得前年の売上が5億米ドル未満の開発企業をベンチャーとして集計
※4:欧米にてオーファンドラッグ指定を承認時までに受けた品目をオーファンとして集計
※5:2022年末時点で欧米で小児適応を取得した品目を小児として集計