よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
製造販売後調査に係るこれまでの取扱い
令和6年1月12日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
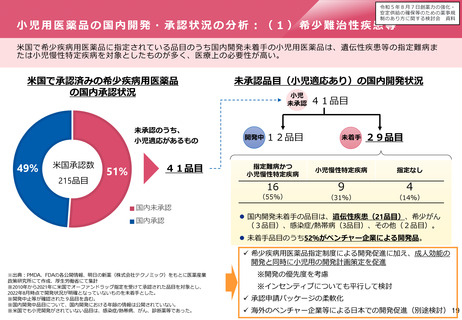
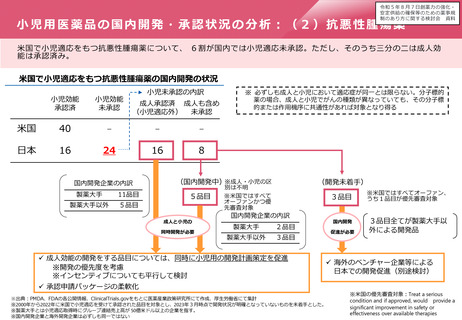
⚫ 製造販売後調査の計画策定については、「医薬品の製造販売後
調査等の実施計画の策定に関する検討の進め方について」
((PMS通知)平成31年3月14日薬生薬審発0314第4号薬生安
発0314第4号厚生労働省医薬・生活衛生局医薬品審査管理課
長・医薬安全対策課長連名通知)により、考え方が示されてい
る。
⚫ PMS通知においては、製造販売後調査等を実施する場合には、
リサーチ・クエスチョンを明確にすることが重要であること、
また、リサーチ・クエスチョンとは、具体的かつ明確な調査・
試験の課題のことであり、対象集団、主たる検討対象の薬剤、
比較対照、対象とする有効性・安全性検討事項及び対象期間の
要素が含まれることなどが示されている。
⚫ その上で、具体的には、右図のとおり、4つのステップにより
計画を策定することとされている。
※このほか、 「医薬品安全性監視の計画について」((ICH E2Eガイドライン) 平成17年9月16日薬食審査発第0916001号薬食安発第0916001
号厚生労働省医薬食品局審査管理課長・安全対策課長連名通知)において、医薬品安全性監視の方法が網羅的に示されている。
56
令和6年1月12日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
⚫ 製造販売後調査の計画策定については、「医薬品の製造販売後
調査等の実施計画の策定に関する検討の進め方について」
((PMS通知)平成31年3月14日薬生薬審発0314第4号薬生安
発0314第4号厚生労働省医薬・生活衛生局医薬品審査管理課
長・医薬安全対策課長連名通知)により、考え方が示されてい
る。
⚫ PMS通知においては、製造販売後調査等を実施する場合には、
リサーチ・クエスチョンを明確にすることが重要であること、
また、リサーチ・クエスチョンとは、具体的かつ明確な調査・
試験の課題のことであり、対象集団、主たる検討対象の薬剤、
比較対照、対象とする有効性・安全性検討事項及び対象期間の
要素が含まれることなどが示されている。
⚫ その上で、具体的には、右図のとおり、4つのステップにより
計画を策定することとされている。
※このほか、 「医薬品安全性監視の計画について」((ICH E2Eガイドライン) 平成17年9月16日薬食審査発第0916001号薬食安発第0916001
号厚生労働省医薬食品局審査管理課長・安全対策課長連名通知)において、医薬品安全性監視の方法が網羅的に示されている。
56