よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年7月10日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
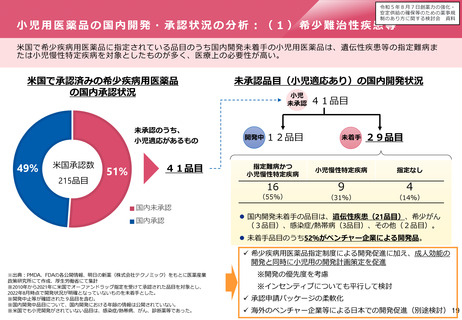
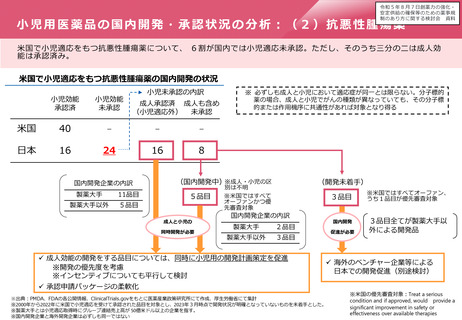
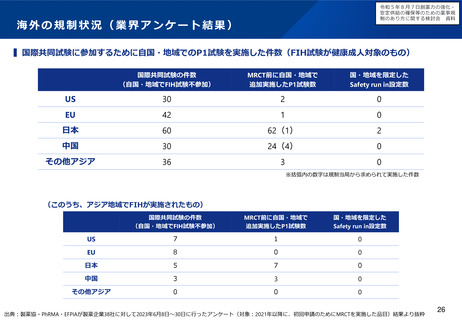
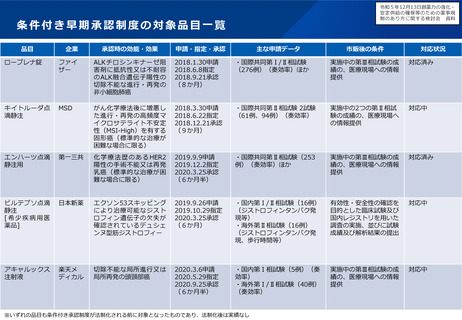
「輪切り」の要件の明確化
主な課題
対応の方向性(案)
▍医学薬学上の妥当性の基準を明確化
▍厳格な「輪切り」の判定
• 左記に例示したような開発の進め方は、創薬開発に
おいては必ずしも不適切なものではないと考えられ
る。
• いわゆる「輪切り申請」は、特定の疾患の患者数に
関して、医学薬学上の明確な理由なしに、「重篤
な」等の接頭語あるいは、ただし書きを追加するこ
とによって、患者数を5万人未満として計算するこ
ととされており、希少疾病用医薬品制度においては
認められていない。
• この解釈が厳格に運用され、本来、開発支援の対象
となるべき疾患領域であるにも関わらず、指定対象
から外れている場合があるとの指摘がある。
(例)
✓ 作用の強い生物学的製剤であり、軽症の患者には使用されること
が想定されないため、重症の患者に限定して開発を進める場合
✓ 対象疾患の患者数は5万人以上であるものの、医薬品による治療
が必要となる患者数は5万人未満であると推定される場合
「輪切り」に該当するとされる場合がある
>
• また、仮に将来的にさらなる適応拡大が想定される
場合であっても、まず直近の開発対象への開発が行
われなければ将来的な拡大もされないことから、希
少疾病用医薬品としての該当性は、企業が開発対象
とする最小単位に対して検討する必要があると考え
られる。
• このため、例えば、年齢層(小児を含む)、治療ラ
イン、リスク分類、投薬の必要性等を含め、医学薬
学上の検討に基づき、高いアンメットニーズがあり
つつも開発が進んでいない範囲に限定した対象疾患
に対して製造販売をしようとするのであれば、当該
疾患については「輪切り」には該当しないことを明
確化してはどうか。
※ ただし、疾患全体の患者数が5万人を大幅に超える場合などは、
推計は複数の根拠に基づき慎重に確認し、最大数を採用するなど保
守的に行うものとする。
14
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
「輪切り」の要件の明確化
主な課題
対応の方向性(案)
▍医学薬学上の妥当性の基準を明確化
▍厳格な「輪切り」の判定
• 左記に例示したような開発の進め方は、創薬開発に
おいては必ずしも不適切なものではないと考えられ
る。
• いわゆる「輪切り申請」は、特定の疾患の患者数に
関して、医学薬学上の明確な理由なしに、「重篤
な」等の接頭語あるいは、ただし書きを追加するこ
とによって、患者数を5万人未満として計算するこ
ととされており、希少疾病用医薬品制度においては
認められていない。
• この解釈が厳格に運用され、本来、開発支援の対象
となるべき疾患領域であるにも関わらず、指定対象
から外れている場合があるとの指摘がある。
(例)
✓ 作用の強い生物学的製剤であり、軽症の患者には使用されること
が想定されないため、重症の患者に限定して開発を進める場合
✓ 対象疾患の患者数は5万人以上であるものの、医薬品による治療
が必要となる患者数は5万人未満であると推定される場合
「輪切り」に該当するとされる場合がある
>
• また、仮に将来的にさらなる適応拡大が想定される
場合であっても、まず直近の開発対象への開発が行
われなければ将来的な拡大もされないことから、希
少疾病用医薬品としての該当性は、企業が開発対象
とする最小単位に対して検討する必要があると考え
られる。
• このため、例えば、年齢層(小児を含む)、治療ラ
イン、リスク分類、投薬の必要性等を含め、医学薬
学上の検討に基づき、高いアンメットニーズがあり
つつも開発が進んでいない範囲に限定した対象疾患
に対して製造販売をしようとするのであれば、当該
疾患については「輪切り」には該当しないことを明
確化してはどうか。
※ ただし、疾患全体の患者数が5万人を大幅に超える場合などは、
推計は複数の根拠に基づき慎重に確認し、最大数を採用するなど保
守的に行うものとする。
14