よむ、つかう、まなぶ。
資料1-2創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会について (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年10月13日創薬力の強化・
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
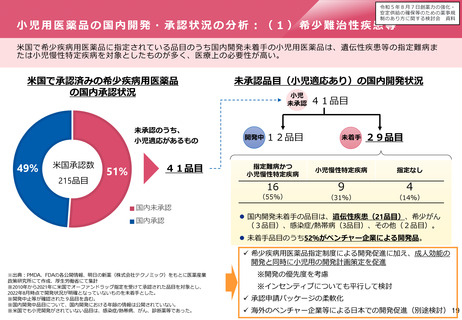
変更カテゴリの日本と欧米の違い(日本で一変とされた変更事項)
⚫ 製薬協が実施したアンケート調査によると、化成品では、日本で一変承認が必要とされた変更事項のうち、海外でも事前承認が必要と
された事項は、米国では38%、EUでは28%であり、多くはなかった。
⚫ バイオ医薬品では、50%以上は海外でも事前承認が必要とされたが、欧州では40%が、米国では25%が30日以内の審査又は薬事手続きな
しとされていた。
日本で一変とされた変更事項の欧米での変更カテゴリ(化成品)
米国
日本で一変とされた変更事項の欧米での変更カテゴリ(バイオ)
EU
米国
EU
PAS
11件
38%
Type II
8件
28%
PAS
21件
75%
Type II
18件
60%
CBE30
11件
38%
Type IB
16件
55%
CBE30
3件
11%
Type IB
8件
27%
CBE0
1件
4%
Type IAIN
0件
0%
CBE0
0件
0%
Type IAIN
0件
0%
Annual report
3件
10%
Type IA
2件
7%
Annual report
2件
7%
Type IA
1件
3%
薬事手続きなし
3件
10%
薬事手続きなし
3件
10%
薬事手続きなし
2件
7%
薬事手続きなし
3件
10%
合計
29件
100%
合計
29件
100%
合計
28件
100%
合計
30件
100%
日本一変、米国(化成品)
薬事手続なし
10%
日本一変、EU(化成品)
Type II
28%
PAS
38%
CBE0
4%
CBE30
38%
Type IB
55%
出典:製薬協が製薬企業66社を対象に2022年5月30日~6月27日に行ったアンケート結果
日本一変、EU(バイオ)
薬事手続なし
10%
Type IA
3%
薬事手続なし
7%
Annual report
7%
薬事手続なし
10%
Type IA
7%
Annual report
10%
日本一変、米国(バイオ)
CBE30
11%
PAS
75%
Type IB
27%
Type II
60%
34
安定供給の確保等のための薬事規
制のあり方に関する検討会 資料
変更カテゴリの日本と欧米の違い(日本で一変とされた変更事項)
⚫ 製薬協が実施したアンケート調査によると、化成品では、日本で一変承認が必要とされた変更事項のうち、海外でも事前承認が必要と
された事項は、米国では38%、EUでは28%であり、多くはなかった。
⚫ バイオ医薬品では、50%以上は海外でも事前承認が必要とされたが、欧州では40%が、米国では25%が30日以内の審査又は薬事手続きな
しとされていた。
日本で一変とされた変更事項の欧米での変更カテゴリ(化成品)
米国
日本で一変とされた変更事項の欧米での変更カテゴリ(バイオ)
EU
米国
EU
PAS
11件
38%
Type II
8件
28%
PAS
21件
75%
Type II
18件
60%
CBE30
11件
38%
Type IB
16件
55%
CBE30
3件
11%
Type IB
8件
27%
CBE0
1件
4%
Type IAIN
0件
0%
CBE0
0件
0%
Type IAIN
0件
0%
Annual report
3件
10%
Type IA
2件
7%
Annual report
2件
7%
Type IA
1件
3%
薬事手続きなし
3件
10%
薬事手続きなし
3件
10%
薬事手続きなし
2件
7%
薬事手続きなし
3件
10%
合計
29件
100%
合計
29件
100%
合計
28件
100%
合計
30件
100%
日本一変、米国(化成品)
薬事手続なし
10%
日本一変、EU(化成品)
Type II
28%
PAS
38%
CBE0
4%
CBE30
38%
Type IB
55%
出典:製薬協が製薬企業66社を対象に2022年5月30日~6月27日に行ったアンケート結果
日本一変、EU(バイオ)
薬事手続なし
10%
Type IA
3%
薬事手続なし
7%
Annual report
7%
薬事手続なし
10%
Type IA
7%
Annual report
10%
日本一変、米国(バイオ)
CBE30
11%
PAS
75%
Type IB
27%
Type II
60%
34