よむ、つかう、まなぶ。
別紙3○先進医療Bに係る新規技術の科学的評価等について (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00067.html |
| 出典情報 | 先進医療会議(第130回 3/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
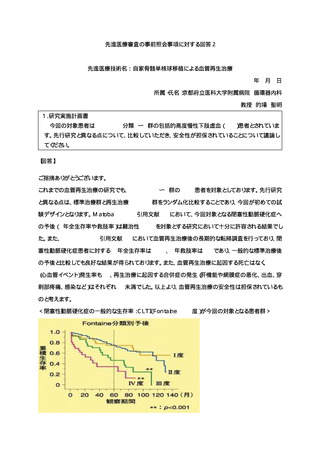
先進医療審査の事前照会事項に対する回答3
先進医療技術名: 自家骨髄単核球移植による血管再生治療
2024 年 2 月 9 日
所属・氏名:京都府立医科大学附属病院 循環器内科
教授 的場 聖明
1. 同意文書6、7頁。
除外基準に、「3他の合併症により、余命が1年未満と考えられる場合。」とありますが、これは、誰が
どのように判断して除外するのでしょうか。「余命」の判断は、かなり困難だと思われます。除外基準
「9 他の重い急性・慢性の医学的・精神的状態や臨床検査値異常があり、試験参加によって危険性が
増す可能性のある、または試験結果の解釈に影響を及ぼす可能性のある場合」で対応可能なのでは
ないでしょうか。スケジュールでは、1年となっていることとの関係だと思いますが、それは、9で対応
可能なのではないでしょうか。
【回答】
ご指摘ありがとうございます。除外基準3と9については、意味合いが重なる部分も確かにありますが、
どちらの基準も必要と考えております。ご指摘の通り、本試験は、52 週程度の観察期間が予定されるた
め、余命が少なくとも1年あると考えられるかたに試験に参加していただくことを想定しています。余命は
その疾患の主治医に判断していただくことになります。試験参加時点で、実際に生きられる時間こそ明
確に分かりませんが、その時点で余命が1年に満たないと考えられるかたについては、本試験はご案内
いたしません。除外基準3を9に含めるとの議論となると、明確な基準が定められなくなり、さらに除外基
準2、4、6も9にまとめてしまえる、という判断もありえてきます。しかし我々としては、あらかじめ想定で
きる基準については明示させていただいた上で、それら個別基準には該当しないが、実際にこの臨床試
験を実施することを考えた場合、どうしても臨床試験に入っていただくわけにはいかないかたを除く受け
皿の基準として、除外基準9を設定しております。除外基準3と9は持つ意味合いが異なり、どちらも必
要な基準と考えております。このままの設定とさせてください。
2. 同意文書 13、14 頁
予測される利益ですが、これは「標準治療群」には適用がない利益です。だとすれば、半分の確率
でしか利益がないことになります。この研究に参加することで、「標準治療群」に半分の確率で振り分
けられるのは、有効性・安全性が治療としてあるのであれば、「不利益」ともいえると思います。そのた
め、「標準治療群」の最大の不利益は、「期待していたのに有効性・安全性が高い治療(利益)が得ら
れない可能性がある、ということです。ここでいう、利益・不利益には、「希望通りにいかない」というこ
とを入れるべきだと思います。
1
18
先進医療技術名: 自家骨髄単核球移植による血管再生治療
2024 年 2 月 9 日
所属・氏名:京都府立医科大学附属病院 循環器内科
教授 的場 聖明
1. 同意文書6、7頁。
除外基準に、「3他の合併症により、余命が1年未満と考えられる場合。」とありますが、これは、誰が
どのように判断して除外するのでしょうか。「余命」の判断は、かなり困難だと思われます。除外基準
「9 他の重い急性・慢性の医学的・精神的状態や臨床検査値異常があり、試験参加によって危険性が
増す可能性のある、または試験結果の解釈に影響を及ぼす可能性のある場合」で対応可能なのでは
ないでしょうか。スケジュールでは、1年となっていることとの関係だと思いますが、それは、9で対応
可能なのではないでしょうか。
【回答】
ご指摘ありがとうございます。除外基準3と9については、意味合いが重なる部分も確かにありますが、
どちらの基準も必要と考えております。ご指摘の通り、本試験は、52 週程度の観察期間が予定されるた
め、余命が少なくとも1年あると考えられるかたに試験に参加していただくことを想定しています。余命は
その疾患の主治医に判断していただくことになります。試験参加時点で、実際に生きられる時間こそ明
確に分かりませんが、その時点で余命が1年に満たないと考えられるかたについては、本試験はご案内
いたしません。除外基準3を9に含めるとの議論となると、明確な基準が定められなくなり、さらに除外基
準2、4、6も9にまとめてしまえる、という判断もありえてきます。しかし我々としては、あらかじめ想定で
きる基準については明示させていただいた上で、それら個別基準には該当しないが、実際にこの臨床試
験を実施することを考えた場合、どうしても臨床試験に入っていただくわけにはいかないかたを除く受け
皿の基準として、除外基準9を設定しております。除外基準3と9は持つ意味合いが異なり、どちらも必
要な基準と考えております。このままの設定とさせてください。
2. 同意文書 13、14 頁
予測される利益ですが、これは「標準治療群」には適用がない利益です。だとすれば、半分の確率
でしか利益がないことになります。この研究に参加することで、「標準治療群」に半分の確率で振り分
けられるのは、有効性・安全性が治療としてあるのであれば、「不利益」ともいえると思います。そのた
め、「標準治療群」の最大の不利益は、「期待していたのに有効性・安全性が高い治療(利益)が得ら
れない可能性がある、ということです。ここでいう、利益・不利益には、「希望通りにいかない」というこ
とを入れるべきだと思います。
1
18