よむ、つかう、まなぶ。
別紙3○先進医療Bに係る新規技術の科学的評価等について (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00067.html |
| 出典情報 | 先進医療会議(第130回 3/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【別添6】
「自家骨髄単核球移植による血管再生治療」の治療計画(申請書類よ
り抜粋)
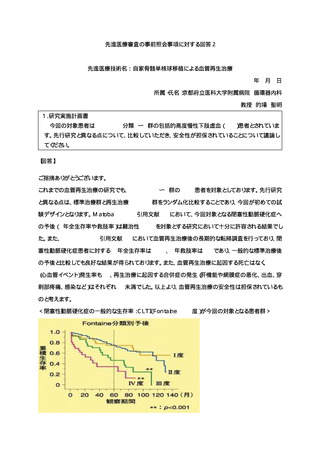
6.治療計画
試験デザイン
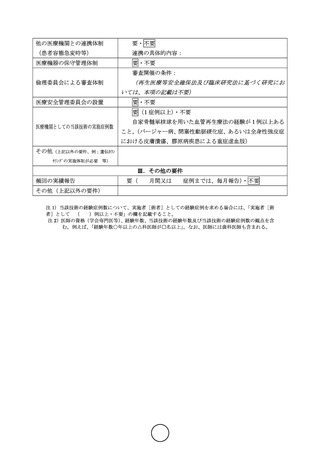
本試験は多施設共同ランダム化介入試験である。薬物治療や運動療法、血行再建術等の現在保険収載
されている標準治療に難治性の包括的高度慢性下肢虚血を対象とし、骨髄単核球細胞を用いた血管再生
治療の有効性を評価する。本試験の対象は閉塞性動脈硬化症に伴う包括的高度慢性下肢虚血で、血行再
建術や小切断が事前に施行されることが多いため、対照群は標準治療群とし、血管再生治療群との群間
で比較を行う。まず仮登録後に EVT や小切断による標準治療を行い、既存治療のみで潰瘍の改善がえら
れた症例や SPP 値が 40mmHg 以上に達した症例は除外し、標準治療に難治性の症例に対し本登録を行い、
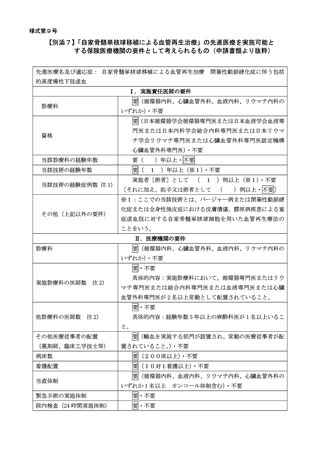
その後 2 群に割り付けを行う。主要評価項目は本登録後 52 週での「イベント発生までの期間(患側肢へ
の切断(大切断又は小切断)又は再 EVT を実施した最も早い日までの期間)
」とし、副次評価項目として
患肢の皮膚潰瘍の面積変化率や SPP/TcPO2 値、また再 EVT の有無等の評価を行う。安全性評価項目とし
て有害事象の有無、心血管イベントの発生や生存率の評価を行う。主要評価の対象となる治療追加の適
切性については、
「治療追加評価委員会」にて事後的に第三者評価を受ける。症例登録期間は告示後 3 年
間、プロトコル期間は 52 週で、最終登録症例のプロトコル期間終了後の転帰調査を含めた期間を試験期
間とする。
プロトコル治療における自家骨髄単核球細胞移植は 1 回とする。
仮:仮登録、本:本登録、R:Randomization
30
「自家骨髄単核球移植による血管再生治療」の治療計画(申請書類よ
り抜粋)
6.治療計画
試験デザイン
本試験は多施設共同ランダム化介入試験である。薬物治療や運動療法、血行再建術等の現在保険収載
されている標準治療に難治性の包括的高度慢性下肢虚血を対象とし、骨髄単核球細胞を用いた血管再生
治療の有効性を評価する。本試験の対象は閉塞性動脈硬化症に伴う包括的高度慢性下肢虚血で、血行再
建術や小切断が事前に施行されることが多いため、対照群は標準治療群とし、血管再生治療群との群間
で比較を行う。まず仮登録後に EVT や小切断による標準治療を行い、既存治療のみで潰瘍の改善がえら
れた症例や SPP 値が 40mmHg 以上に達した症例は除外し、標準治療に難治性の症例に対し本登録を行い、
その後 2 群に割り付けを行う。主要評価項目は本登録後 52 週での「イベント発生までの期間(患側肢へ
の切断(大切断又は小切断)又は再 EVT を実施した最も早い日までの期間)
」とし、副次評価項目として
患肢の皮膚潰瘍の面積変化率や SPP/TcPO2 値、また再 EVT の有無等の評価を行う。安全性評価項目とし
て有害事象の有無、心血管イベントの発生や生存率の評価を行う。主要評価の対象となる治療追加の適
切性については、
「治療追加評価委員会」にて事後的に第三者評価を受ける。症例登録期間は告示後 3 年
間、プロトコル期間は 52 週で、最終登録症例のプロトコル期間終了後の転帰調査を含めた期間を試験期
間とする。
プロトコル治療における自家骨髄単核球細胞移植は 1 回とする。
仮:仮登録、本:本登録、R:Randomization
30