よむ、つかう、まなぶ。
別紙3○先進医療Bに係る新規技術の科学的評価等について (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00067.html |
| 出典情報 | 先進医療会議(第130回 3/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
保険収載までのロードマップ
新しい
臨床研究等の
追加を検討
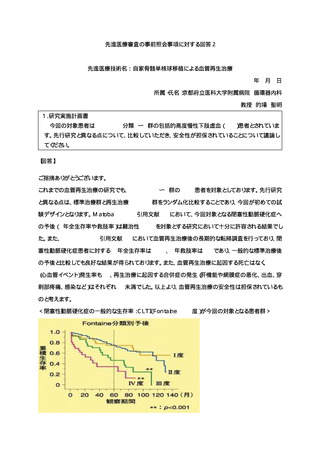
先進医療技術名:自家骨髄単核球移植による血管再生治療
先進医療での適応症:閉塞性動脈硬化症に伴う包括的高度慢性下肢虚血
臨床研究
・試験名:自家骨髄単核球細胞移植
による末梢閉塞性動脈疾患患者の血
管新生治療に関する多施設臨床試験
・ 試験デザイン:多施設単群前向き
観察研究
・ 期間:追跡期間3年間
・ 被験者数:115例
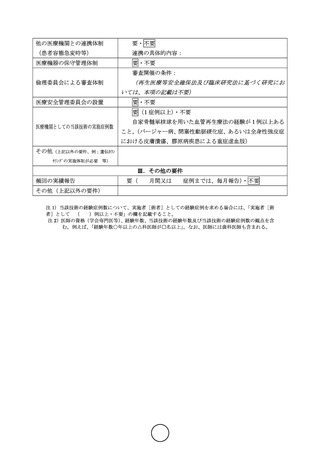
・ 結果の概要: ASO群の全生存率お
よび下肢切断回避率はそれぞれ80%、
60%
当該先進医療における
選択基準: 20~85歳の既存治療で効果
不十分の包括的高度慢性下肢虚血を呈する
閉塞性動脈硬化症患者
除外基準:原疾患のコントロールが不良な
患者、手術が危険な患者、悪性腫瘍などの
合併症をもつ患者など
予想される有害事象:骨髄液採取部位およ
び筋肉注射部位の疼痛、出血、感染症、麻
酔時のアレルギーなど
先進医療
保険収載に
至らない場合
・ 試験名:閉塞性動脈硬化症に伴う包括的高度慢
性下肢虚血に対する自家骨髄単核球細胞を用いた
血管再生治療
・ 試験デザイン:多施設2群ランダム化比較試験
・ 期間:jRCT公表日~ 5年6ヶ月
・ 被験者数: 66例
・ 主要評価項目:患側肢への切断(大切断又は小
切断)又は再EVTを実施した最も早い日までの期間
・ 副次評価項目:疼痛VASやSPP/TcPO2値、皮膚潰
瘍の面積変化率など
保
険
収
載
海外での現状
保険適用:米国(無)、英国(無)、フランス(無)、ドイツ(無)、
カナダ(無)、オーストラリア(無)、その他(無)
ガイドライン記載:(無)
進行中の臨床試験(無)
本邦での現状
ガイドライン記載:(あり)
→ 2022年改訂版末梢動脈疾患ガイドライン
4.3.9再生医療 CLTIに対する遺伝子/細胞治療では,虚血組織における微小
循環の改善が期待される
21
進行中の臨床試験(無)
新しい
臨床研究等の
追加を検討
先進医療技術名:自家骨髄単核球移植による血管再生治療
先進医療での適応症:閉塞性動脈硬化症に伴う包括的高度慢性下肢虚血
臨床研究
・試験名:自家骨髄単核球細胞移植
による末梢閉塞性動脈疾患患者の血
管新生治療に関する多施設臨床試験
・ 試験デザイン:多施設単群前向き
観察研究
・ 期間:追跡期間3年間
・ 被験者数:115例
・ 結果の概要: ASO群の全生存率お
よび下肢切断回避率はそれぞれ80%、
60%
当該先進医療における
選択基準: 20~85歳の既存治療で効果
不十分の包括的高度慢性下肢虚血を呈する
閉塞性動脈硬化症患者
除外基準:原疾患のコントロールが不良な
患者、手術が危険な患者、悪性腫瘍などの
合併症をもつ患者など
予想される有害事象:骨髄液採取部位およ
び筋肉注射部位の疼痛、出血、感染症、麻
酔時のアレルギーなど
先進医療
保険収載に
至らない場合
・ 試験名:閉塞性動脈硬化症に伴う包括的高度慢
性下肢虚血に対する自家骨髄単核球細胞を用いた
血管再生治療
・ 試験デザイン:多施設2群ランダム化比較試験
・ 期間:jRCT公表日~ 5年6ヶ月
・ 被験者数: 66例
・ 主要評価項目:患側肢への切断(大切断又は小
切断)又は再EVTを実施した最も早い日までの期間
・ 副次評価項目:疼痛VASやSPP/TcPO2値、皮膚潰
瘍の面積変化率など
保
険
収
載
海外での現状
保険適用:米国(無)、英国(無)、フランス(無)、ドイツ(無)、
カナダ(無)、オーストラリア(無)、その他(無)
ガイドライン記載:(無)
進行中の臨床試験(無)
本邦での現状
ガイドライン記載:(あり)
→ 2022年改訂版末梢動脈疾患ガイドライン
4.3.9再生医療 CLTIに対する遺伝子/細胞治療では,虚血組織における微小
循環の改善が期待される
21
進行中の臨床試験(無)