よむ、つかう、まなぶ。
資料4-1 エルトロンボパグ オラミン (10 ページ)
出典
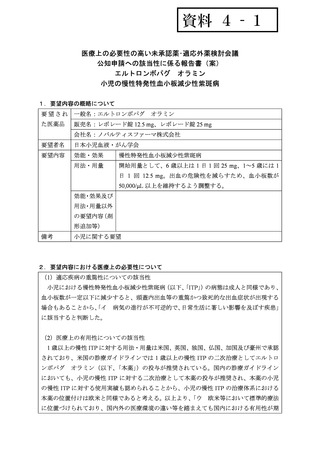
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-84
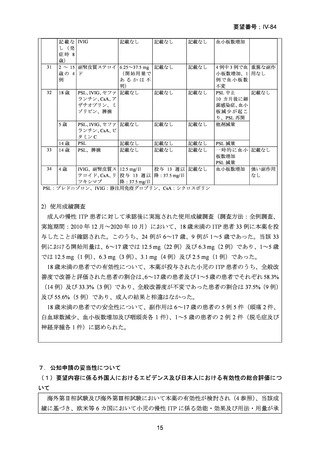
5.要望内容に係る国内外の公表文献・成書等について
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
代表的な公表論文の概略について、以下に示す。
<海外における臨床試験等>
なし。
<日本における臨床試験等>
なし。
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
代表的な公表文献の概略について、以下に示す。
1)Eltrombopag for use in children with immune thrombocytopenia.(Blood Adv 2018; 2: 454-61)
9)
小児の ITP に対する本薬の投与に係る総説であり、以下のように記載されている。
本薬の有効性及び安全性は、小児の ITP 患者を対象とした PETIT 試験 7)及び PETIT2
試験 8)で評価された。これらの試験において、本薬の投与により、血小板数の改善、
出血の重症度の低下、ITP に対する併用治療の減少又は中止が認められた。
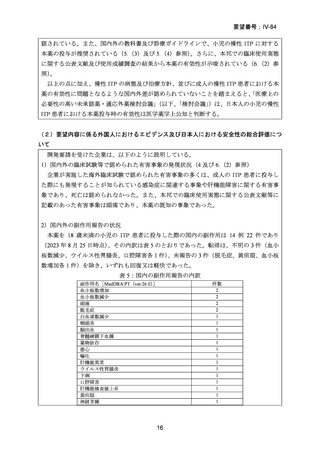
PETIT 試験及び PETIT2 試験の結果に基づき、本薬の開始用量は 1 歳以上 6 歳未満
で 1 日 25 mg、6 歳以上で 1 日 50 mg とされ、投与開始 2 週間後以降の投与量の調節
方法は表 3 のとおりである。投与量が安定した後は、1 カ月に 1 回全血球計算を行う
必要がある。
表 3:本薬の投与の調節
血小板数
50,000/μL 未満
200,000/μL 以上、400,000/μL 未満
投与量の調節
12.5 mg 増量する。最大 75 mg まで
とする。
12.5 mg 減量する。
400,000/μL 以上
投与中止
最低用量を 2 週間継続、且つ
400,000/μL 以上
投与中止
血液検査
2 週間後に血小板数を再度確認す
る。
2 週間後に血小板数を再度確認す
る。
2 週間後に血小板数を再度確認す
る。
血小板数が 150,000/μL 未満になっ
たら 12.5 mg 減量して投与を再開
する
―
本薬の投与中止のタイミングに関するコンセンサスは得られていない。
東アジア人の小児における開始用量は、6 歳以上で 1 日 25 mg、1~5 歳では 1 日
12.5 mg とする。また、肝障害を併発している場合、薬物濃度が上昇することに注意
が必要である。
本薬は錠剤のみが承認されているが、粉砕してはならない。PETIT 試験及び PETIT2
試験では粉末の経口懸濁液が利用可能であったが、当該製剤は市販されていない。
10
40 / 213
5.要望内容に係る国内外の公表文献・成書等について
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
代表的な公表論文の概略について、以下に示す。
<海外における臨床試験等>
なし。
<日本における臨床試験等>
なし。
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
代表的な公表文献の概略について、以下に示す。
1)Eltrombopag for use in children with immune thrombocytopenia.(Blood Adv 2018; 2: 454-61)
9)
小児の ITP に対する本薬の投与に係る総説であり、以下のように記載されている。
本薬の有効性及び安全性は、小児の ITP 患者を対象とした PETIT 試験 7)及び PETIT2
試験 8)で評価された。これらの試験において、本薬の投与により、血小板数の改善、
出血の重症度の低下、ITP に対する併用治療の減少又は中止が認められた。
PETIT 試験及び PETIT2 試験の結果に基づき、本薬の開始用量は 1 歳以上 6 歳未満
で 1 日 25 mg、6 歳以上で 1 日 50 mg とされ、投与開始 2 週間後以降の投与量の調節
方法は表 3 のとおりである。投与量が安定した後は、1 カ月に 1 回全血球計算を行う
必要がある。
表 3:本薬の投与の調節
血小板数
50,000/μL 未満
200,000/μL 以上、400,000/μL 未満
投与量の調節
12.5 mg 増量する。最大 75 mg まで
とする。
12.5 mg 減量する。
400,000/μL 以上
投与中止
最低用量を 2 週間継続、且つ
400,000/μL 以上
投与中止
血液検査
2 週間後に血小板数を再度確認す
る。
2 週間後に血小板数を再度確認す
る。
2 週間後に血小板数を再度確認す
る。
血小板数が 150,000/μL 未満になっ
たら 12.5 mg 減量して投与を再開
する
―
本薬の投与中止のタイミングに関するコンセンサスは得られていない。
東アジア人の小児における開始用量は、6 歳以上で 1 日 25 mg、1~5 歳では 1 日
12.5 mg とする。また、肝障害を併発している場合、薬物濃度が上昇することに注意
が必要である。
本薬は錠剤のみが承認されているが、粉砕してはならない。PETIT 試験及び PETIT2
試験では粉末の経口懸濁液が利用可能であったが、当該製剤は市販されていない。
10
40 / 213