よむ、つかう、まなぶ。
資料4-1 エルトロンボパグ オラミン (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-84
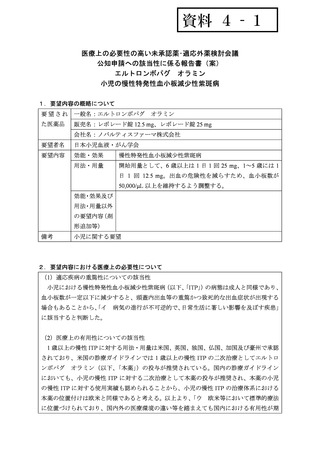
未知の副作用は 10 件認められ、このうち 2 件以上発生した副作用は血小板数減少であっ
た。しかしながら、血小板数減少については原疾患がリスク因子であり一定割合の ITP 患
者でこれらの合併症を有すると考えられること、及びその他の副作用を含め小児集団にお
いて特異的に発現した副作用はないことから、追加の注意喚起は不要と判断した。
また、海外の副作用報告においても、最も多く発現した副作用は血小板数減少であった。
その他の副作用も主に血栓塞栓症や出血に関する事象であり、発現した事象や重症度の傾
向は国内の副作用と変わらなかった。
以上より、検討会議は以下のように判断する。
小児の ITP に対して本薬が承認されている海外において、小児の ITP 特有のリスクは報
告されていない。また、国内で本薬を小児の ITP 患者に投与した際に 2 件以上報告された
未知の副作用である血小板数減少は、原疾患の病態から想定される事象であった。したが
って、成人の慢性 ITP 患者における本薬の安全性に問題となるような国内外差は認められ
ていないことも踏まえると、成人と同様のモニタリングや用量調節がなされるのであれば、
日本人の小児の慢性 ITP 患者における本薬投与時の安全性は管理可能である。
注 5)企業の自発報告に加え、使用成績調査で報告された事象も含む。
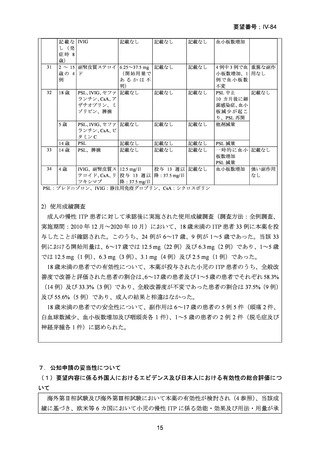
(3)要望内容に係る公知申請の妥当性について
本薬について、欧米等 6 カ国で、小児での慢性 ITP に係る効能・効果及び用法・用量が
承認されており、国内外の教科書、診療ガイドライン等の記載内容及び国内の使用実態か
ら、一次治療に反応不良な小児の慢性 ITP 患者において本薬を用いた治療が標準的に行わ
れていると判断できる(5.(3)、(4)及び 6.(2)参照)。
有効性について、海外第Ⅱ相試験及び海外第Ⅲ相試験において小児の慢性 ITP 患者での
本薬の有効性が示されており、本邦での臨床使用実態に関する公表文献及び使用成績調査
の結果を踏まえると、日本人の小児の慢性 ITP 患者における有効性も期待できる(7.(1)
参照)。
安全性について、海外臨床試験成績及び国内の製造販売後の情報を踏まえると、成人の
慢性 ITP 患者に対する投与時と同様の管理がなされるのであれば、
日本人の小児の慢性 ITP
患者に本薬を投与した際のリスクはベネフィットを上回らないと判断する(7.(2)参照)。
以上より、検討会議は、小児の慢性 ITP に対する本薬の有用性は、医学薬学上公知であ
ると判断する。
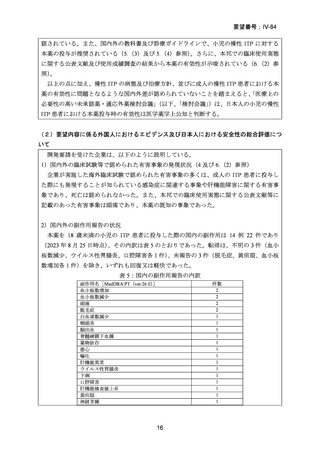
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
効能・効果及び効能・効果に関連する注意について、以下のような設定とすることが適
当と検討会議は考える。
17
47 / 213
未知の副作用は 10 件認められ、このうち 2 件以上発生した副作用は血小板数減少であっ
た。しかしながら、血小板数減少については原疾患がリスク因子であり一定割合の ITP 患
者でこれらの合併症を有すると考えられること、及びその他の副作用を含め小児集団にお
いて特異的に発現した副作用はないことから、追加の注意喚起は不要と判断した。
また、海外の副作用報告においても、最も多く発現した副作用は血小板数減少であった。
その他の副作用も主に血栓塞栓症や出血に関する事象であり、発現した事象や重症度の傾
向は国内の副作用と変わらなかった。
以上より、検討会議は以下のように判断する。
小児の ITP に対して本薬が承認されている海外において、小児の ITP 特有のリスクは報
告されていない。また、国内で本薬を小児の ITP 患者に投与した際に 2 件以上報告された
未知の副作用である血小板数減少は、原疾患の病態から想定される事象であった。したが
って、成人の慢性 ITP 患者における本薬の安全性に問題となるような国内外差は認められ
ていないことも踏まえると、成人と同様のモニタリングや用量調節がなされるのであれば、
日本人の小児の慢性 ITP 患者における本薬投与時の安全性は管理可能である。
注 5)企業の自発報告に加え、使用成績調査で報告された事象も含む。
(3)要望内容に係る公知申請の妥当性について
本薬について、欧米等 6 カ国で、小児での慢性 ITP に係る効能・効果及び用法・用量が
承認されており、国内外の教科書、診療ガイドライン等の記載内容及び国内の使用実態か
ら、一次治療に反応不良な小児の慢性 ITP 患者において本薬を用いた治療が標準的に行わ
れていると判断できる(5.(3)、(4)及び 6.(2)参照)。
有効性について、海外第Ⅱ相試験及び海外第Ⅲ相試験において小児の慢性 ITP 患者での
本薬の有効性が示されており、本邦での臨床使用実態に関する公表文献及び使用成績調査
の結果を踏まえると、日本人の小児の慢性 ITP 患者における有効性も期待できる(7.(1)
参照)。
安全性について、海外臨床試験成績及び国内の製造販売後の情報を踏まえると、成人の
慢性 ITP 患者に対する投与時と同様の管理がなされるのであれば、
日本人の小児の慢性 ITP
患者に本薬を投与した際のリスクはベネフィットを上回らないと判断する(7.(2)参照)。
以上より、検討会議は、小児の慢性 ITP に対する本薬の有用性は、医学薬学上公知であ
ると判断する。
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
効能・効果及び効能・効果に関連する注意について、以下のような設定とすることが適
当と検討会議は考える。
17
47 / 213