よむ、つかう、まなぶ。
資料4-1 エルトロンボパグ オラミン (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-84
31
32
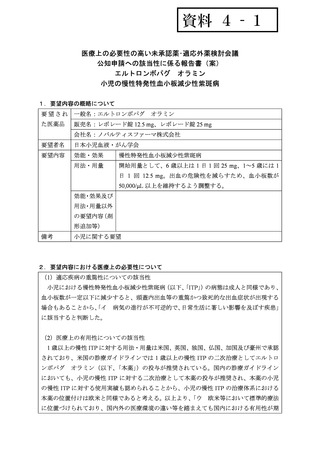
記 載 な IVIG
記載なし
記載なし
し(発
症時 8
歳)
2 ~ 15 副腎皮質ステロイ 6.25~37.5 mg 記載なし
歳の 4 ド
(開始用量で
例
あるかは不
明)
18 歳
PSL、IVIG、セファ 記載なし
記載なし
ランチン、CsA、ア
ザチオプリン、ミ
ゾリビン、脾摘
記載なし
血小板数増加
記載なし
5歳
記載なし
記載なし
4 例中 3 例で血 重篤な副作
小板数増加、1 用なし
例で血小板数
不変
PSL 中止
記載なし
10 カ月後に細
菌感染症、血小
板減少が起こ
り、PSL 再開
他剤減量
記載なし
記載なし
記載なし
記載なし
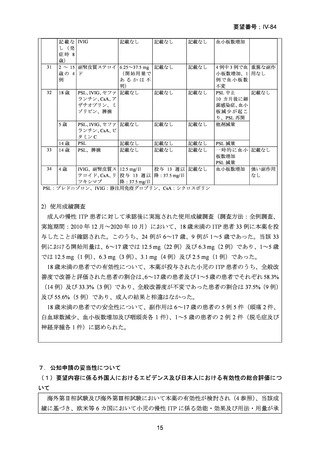
33
14 歳
14 歳
34
4歳
PSL、IVIG、セファ 記載なし
ランチン、CsA、ビ
タミン C
PSL
記載なし
PSL、脾摘
記載なし
記載なし
IVIG、副腎皮質ス 12.5 mg/日
投 与 13 週 以 記載なし
テロイド、CsA、リ 投 与 13 週 以 降:37.5 mg/日
ツキシマブ
降:37.5 mg/日
PSL:プレドニゾロン、IVIG:静注用免疫グロブリン、CsA:シクロスポリン
PSL 減量
一 時 的 に 血 小 記載なし
板数増加
PSL 減量
血小板数増加 強い副作用
なし
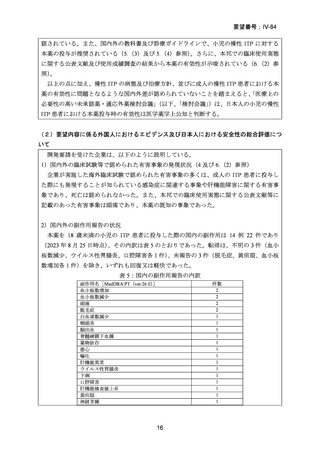
2)使用成績調査
成人の慢性 ITP 患者に対して承認後に実施された使用成績調査(調査方法:全例調査、
実施期間:2010 年 12 月~2020 年 10 月)において、18 歳未満の ITP 患者 33 例に本薬を投
与したことが確認された。このうち、24 例が 6~17 歳、9 例が 1~5 歳であった。当該 33
例における開始用量は、6~17 歳では 12.5 mg(22 例)及び 6.3 mg(2 例)であり、1~5 歳
では 12.5 mg(1 例)
、6.3 mg(3 例)
、3.1 mg(4 例)及び 2.5 mg(1 例)であった。
18 歳未満の患者での有効性について、本薬が投与された小児の ITP 患者のうち、全般改
善度で改善と評価された患者の割合は、6~17 歳の患者及び 1~5 歳の患者でそれぞれ 58.3%
(14 例)及び 33.3%(3 例)であり、全般改善度が不変であった患者の割合は 37.5%(9 例)
及び 55.6%(5 例)であり、成人の結果と相違はなかった。
18 歳未満の患者での安全性について、副作用は 6~17 歳の患者の 5 例 5 件(頭痛 2 件、
白血球数減少、血小板数増加及び咽頭炎各 1 件)
、1~5 歳の患者の 2 例 2 件(脱毛症及び
神経芽腫各 1 件)に認められた。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
海外第Ⅱ相試験及び海外第Ⅲ相試験において本薬の有効性が検討され(4 参照)
、当該成
績に基づき、欧米等 6 カ国において小児の慢性 ITP に係る効能・効果及び用法・用量が承
15
45 / 213
31
32
記 載 な IVIG
記載なし
記載なし
し(発
症時 8
歳)
2 ~ 15 副腎皮質ステロイ 6.25~37.5 mg 記載なし
歳の 4 ド
(開始用量で
例
あるかは不
明)
18 歳
PSL、IVIG、セファ 記載なし
記載なし
ランチン、CsA、ア
ザチオプリン、ミ
ゾリビン、脾摘
記載なし
血小板数増加
記載なし
5歳
記載なし
記載なし
4 例中 3 例で血 重篤な副作
小板数増加、1 用なし
例で血小板数
不変
PSL 中止
記載なし
10 カ月後に細
菌感染症、血小
板減少が起こ
り、PSL 再開
他剤減量
記載なし
記載なし
記載なし
記載なし
33
14 歳
14 歳
34
4歳
PSL、IVIG、セファ 記載なし
ランチン、CsA、ビ
タミン C
PSL
記載なし
PSL、脾摘
記載なし
記載なし
IVIG、副腎皮質ス 12.5 mg/日
投 与 13 週 以 記載なし
テロイド、CsA、リ 投 与 13 週 以 降:37.5 mg/日
ツキシマブ
降:37.5 mg/日
PSL:プレドニゾロン、IVIG:静注用免疫グロブリン、CsA:シクロスポリン
PSL 減量
一 時 的 に 血 小 記載なし
板数増加
PSL 減量
血小板数増加 強い副作用
なし
2)使用成績調査
成人の慢性 ITP 患者に対して承認後に実施された使用成績調査(調査方法:全例調査、
実施期間:2010 年 12 月~2020 年 10 月)において、18 歳未満の ITP 患者 33 例に本薬を投
与したことが確認された。このうち、24 例が 6~17 歳、9 例が 1~5 歳であった。当該 33
例における開始用量は、6~17 歳では 12.5 mg(22 例)及び 6.3 mg(2 例)であり、1~5 歳
では 12.5 mg(1 例)
、6.3 mg(3 例)
、3.1 mg(4 例)及び 2.5 mg(1 例)であった。
18 歳未満の患者での有効性について、本薬が投与された小児の ITP 患者のうち、全般改
善度で改善と評価された患者の割合は、6~17 歳の患者及び 1~5 歳の患者でそれぞれ 58.3%
(14 例)及び 33.3%(3 例)であり、全般改善度が不変であった患者の割合は 37.5%(9 例)
及び 55.6%(5 例)であり、成人の結果と相違はなかった。
18 歳未満の患者での安全性について、副作用は 6~17 歳の患者の 5 例 5 件(頭痛 2 件、
白血球数減少、血小板数増加及び咽頭炎各 1 件)
、1~5 歳の患者の 2 例 2 件(脱毛症及び
神経芽腫各 1 件)に認められた。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
海外第Ⅱ相試験及び海外第Ⅲ相試験において本薬の有効性が検討され(4 参照)
、当該成
績に基づき、欧米等 6 カ国において小児の慢性 ITP に係る効能・効果及び用法・用量が承
15
45 / 213