よむ、つかう、まなぶ。
資料4-1 エルトロンボパグ オラミン (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-84
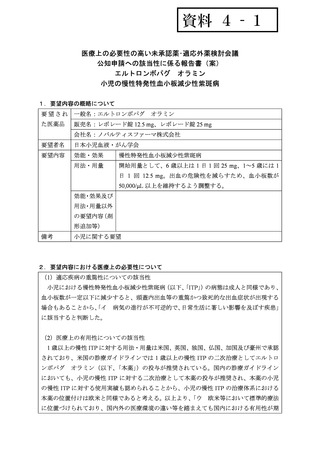
<投与中止>
成人及び 1~17 歳の小児
1 日 1 回 75 mg を 4 週間投与しても臨床的に重要な出血を防ぐため
に十分なレベルの血小板数の増加が認められない場合は、投与を中
止すること。
承認年月(または豪 2016 年 3 月 29 日
州における開発の有
無)
備考
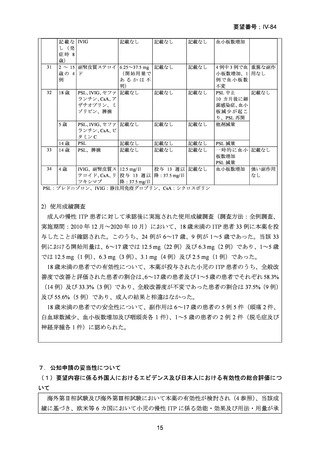
4.要望内容について企業側で実施した海外臨床試験成績について
1) 海外第Ⅱ相試験(TRA108062/PETIT)
(Lancet Haematol 2015; 2: e315-25)7)
1~17 歳の慢性 ITP 患者注 1)を対象に、本薬の有効性及び安全性を検討するプラセボ対照
無作為化二重盲検比較試験が実施された注 2)。
年齢(12~17 歳、6~11 歳、1~5 歳)を層別因子として、組み入れられた 67 例が本薬群
(45 例)又はプラセボ群(22 例)に無作為に割り付けられ、本薬又はプラセボが 1 日 1 回、
7 週間投与された。開始用量は、年齢、体重及び人種により表 1 のように設定され、血小板
数が 50,000~200,000/ L となるように、最大用量である 75 mg 又は 2 mg/kg まで投与量を
調節することとされた。血小板数が 2 週連続で 50,000/ L 未満となった場合、12.5 mg 増量
し、血小板数が 200,000/ L 超となった場合、2 週間ごとに 12.5 mg 減量することとされた。
血小板数が 400,000/ L 超となった場合、投与を中断し、血小板数が 150,000/ L 未満となっ
た後に 12.5 mg 減量して投与を再開することとされた。
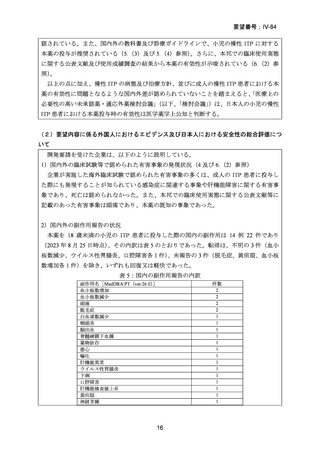
表 1:TRA108062/PETIT 試験における開始用量
年齢
12~17 歳
6~11 歳
人種
-
非東アジア人
体重
-
27 kg 以上
27 kg 未満
27 kg 以上
27 kg 未満
-
-
東アジア人
1~5 歳
非東アジア人
東アジア人
開始用量
37.5 mg
50 mg
25 mg
25 mg
12.5 mg
1.5 mg/kg
0.8 mg/kg
有効性について、主要評価項目である投与 1~6 週目までの期間に救済薬の投与なしに血
小板数が少なくとも 1 回、50,000/ L 以上に達した被験者の割合は、本薬群及びプラセボ群
でそれぞれ 62%(28/45 例)及び 32%(7/22 例)であった。
安全性について、本薬群で認められた主な有害事象は、頭痛(13 例)
、上気道感染(11 例)
及び下痢(7 例)であった。重篤な有害事象として、本薬群で貧血、発熱性好中球減少症、
好中球減少症、尿路感染・発熱が各 1 例に認められた。死亡、悪性腫瘍及び血栓症は認め
8
38 / 213
<投与中止>
成人及び 1~17 歳の小児
1 日 1 回 75 mg を 4 週間投与しても臨床的に重要な出血を防ぐため
に十分なレベルの血小板数の増加が認められない場合は、投与を中
止すること。
承認年月(または豪 2016 年 3 月 29 日
州における開発の有
無)
備考
4.要望内容について企業側で実施した海外臨床試験成績について
1) 海外第Ⅱ相試験(TRA108062/PETIT)
(Lancet Haematol 2015; 2: e315-25)7)
1~17 歳の慢性 ITP 患者注 1)を対象に、本薬の有効性及び安全性を検討するプラセボ対照
無作為化二重盲検比較試験が実施された注 2)。
年齢(12~17 歳、6~11 歳、1~5 歳)を層別因子として、組み入れられた 67 例が本薬群
(45 例)又はプラセボ群(22 例)に無作為に割り付けられ、本薬又はプラセボが 1 日 1 回、
7 週間投与された。開始用量は、年齢、体重及び人種により表 1 のように設定され、血小板
数が 50,000~200,000/ L となるように、最大用量である 75 mg 又は 2 mg/kg まで投与量を
調節することとされた。血小板数が 2 週連続で 50,000/ L 未満となった場合、12.5 mg 増量
し、血小板数が 200,000/ L 超となった場合、2 週間ごとに 12.5 mg 減量することとされた。
血小板数が 400,000/ L 超となった場合、投与を中断し、血小板数が 150,000/ L 未満となっ
た後に 12.5 mg 減量して投与を再開することとされた。
表 1:TRA108062/PETIT 試験における開始用量
年齢
12~17 歳
6~11 歳
人種
-
非東アジア人
体重
-
27 kg 以上
27 kg 未満
27 kg 以上
27 kg 未満
-
-
東アジア人
1~5 歳
非東アジア人
東アジア人
開始用量
37.5 mg
50 mg
25 mg
25 mg
12.5 mg
1.5 mg/kg
0.8 mg/kg
有効性について、主要評価項目である投与 1~6 週目までの期間に救済薬の投与なしに血
小板数が少なくとも 1 回、50,000/ L 以上に達した被験者の割合は、本薬群及びプラセボ群
でそれぞれ 62%(28/45 例)及び 32%(7/22 例)であった。
安全性について、本薬群で認められた主な有害事象は、頭痛(13 例)
、上気道感染(11 例)
及び下痢(7 例)であった。重篤な有害事象として、本薬群で貧血、発熱性好中球減少症、
好中球減少症、尿路感染・発熱が各 1 例に認められた。死亡、悪性腫瘍及び血栓症は認め
8
38 / 213