よむ、つかう、まなぶ。
資料4-1 エルトロンボパグ オラミン (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-84
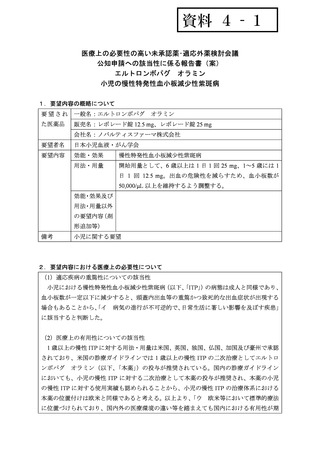
がITPの治療薬として承認されている。
TPO-RAは、成人のみでなく小児にも有効である。本薬は、他の治療(副腎皮質ステ
ロイド、免疫グロブリン等)に抵抗性で、6カ月以上持続する一次性ITPの1歳以上の
小児の患者における治療に用いる。
小児では一般的に脾摘は避けるべきである。
本薬の小児における有害事象として、特に高用量投与時にトランスアミナーゼ増加
の可能性が報告されているが、中和抗体や骨髄異形成等の重篤な有害事象は報告さ
れていない。軽度で可逆的なレチクリン線維増殖が確認されたとの報告もあるもの
の、系統的な研究は行われていない。その他、報告されている副作用として上気道感
染や発熱がある。
鉄キレート剤である本薬が小児のITP患者の鉄欠乏症の原因となることが報告され
ている。
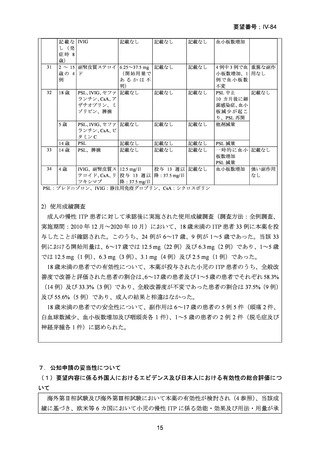
<日本におけるガイドライン等>
1) 日本小児血液・がん学会 2022 年小児免疫性血小板減少症診療ガイドライン(日本小児
血液・がん学会雑誌 2022; 59: 50-7)16)
以下のように記載されている。
一次治療に反応不良であり、粘膜出血のある又はHRQoLの低下したITP患者には、
TPO-RAを推奨する(推奨グレード1A)。本薬の開始量は1日1回12.5 mgを推奨する
(推奨グレード1C)。
一次治療に反応不良であり、粘膜出血のある又はHRQoLの低下したITP患者には、脾
摘に優先してTPO-RA、リツキシマブの投与を推奨する(推奨グレード2C)。
本薬とロミプロスチムのどちらを優先して投与すべきかについては、有効性及び安
全性に差がないため、投与方法、合併症の発現有無、患者希望等を考慮して判断する
(推奨グレードなし)。
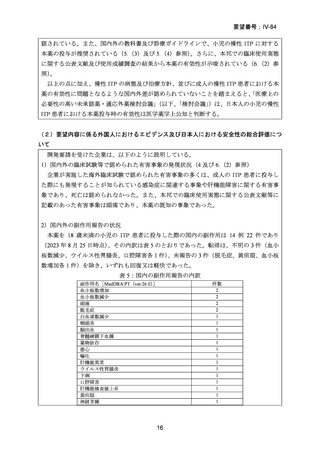
6.本邦での開発状況(経緯)及び使用実態について
(1)要望内容に係る本邦での開発状況(経緯)等について
本邦において、小児の ITP に対する本薬の開発は行われていない。
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
要望内容に係る本薬の使用実態として、以下の内容が報告されている。
1)本邦での臨床使用実態に関する文献報告 14)~39)
小児の慢性 ITP に対する本薬の使用実態に関する情報が記載された報告は、表 4 のとお
りであった。
13
43 / 213
がITPの治療薬として承認されている。
TPO-RAは、成人のみでなく小児にも有効である。本薬は、他の治療(副腎皮質ステ
ロイド、免疫グロブリン等)に抵抗性で、6カ月以上持続する一次性ITPの1歳以上の
小児の患者における治療に用いる。
小児では一般的に脾摘は避けるべきである。
本薬の小児における有害事象として、特に高用量投与時にトランスアミナーゼ増加
の可能性が報告されているが、中和抗体や骨髄異形成等の重篤な有害事象は報告さ
れていない。軽度で可逆的なレチクリン線維増殖が確認されたとの報告もあるもの
の、系統的な研究は行われていない。その他、報告されている副作用として上気道感
染や発熱がある。
鉄キレート剤である本薬が小児のITP患者の鉄欠乏症の原因となることが報告され
ている。
<日本におけるガイドライン等>
1) 日本小児血液・がん学会 2022 年小児免疫性血小板減少症診療ガイドライン(日本小児
血液・がん学会雑誌 2022; 59: 50-7)16)
以下のように記載されている。
一次治療に反応不良であり、粘膜出血のある又はHRQoLの低下したITP患者には、
TPO-RAを推奨する(推奨グレード1A)。本薬の開始量は1日1回12.5 mgを推奨する
(推奨グレード1C)。
一次治療に反応不良であり、粘膜出血のある又はHRQoLの低下したITP患者には、脾
摘に優先してTPO-RA、リツキシマブの投与を推奨する(推奨グレード2C)。
本薬とロミプロスチムのどちらを優先して投与すべきかについては、有効性及び安
全性に差がないため、投与方法、合併症の発現有無、患者希望等を考慮して判断する
(推奨グレードなし)。
6.本邦での開発状況(経緯)及び使用実態について
(1)要望内容に係る本邦での開発状況(経緯)等について
本邦において、小児の ITP に対する本薬の開発は行われていない。
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
要望内容に係る本薬の使用実態として、以下の内容が報告されている。
1)本邦での臨床使用実態に関する文献報告 14)~39)
小児の慢性 ITP に対する本薬の使用実態に関する情報が記載された報告は、表 4 のとお
りであった。
13
43 / 213