よむ、つかう、まなぶ。
資料1-1 厚生労働省 御提出資料 (12 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/240328/medical09_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第9回 3/28)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
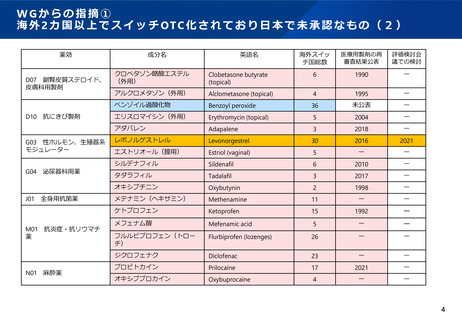
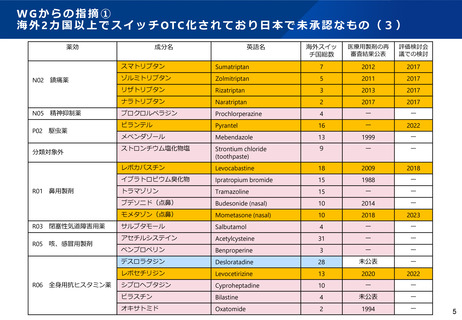
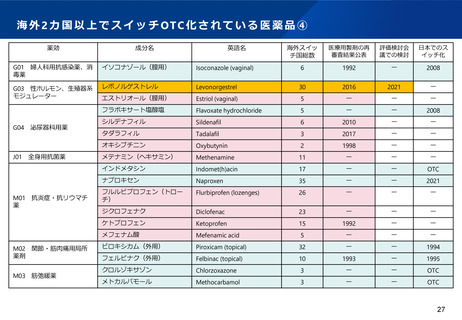
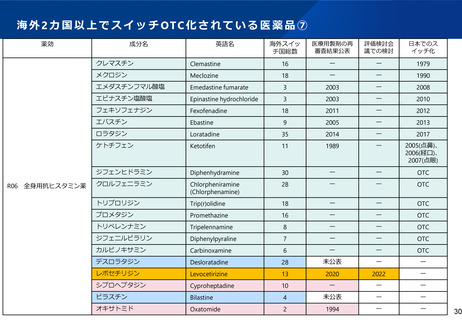
WGからの指摘③
ス イ ッ チ OTC 化 の プ ロ セ ス を、 PM DA 、評 価 検討 会 議 、薬 事 ・食 品 衛 生審 議
会に分割している理由及び必要性(1)
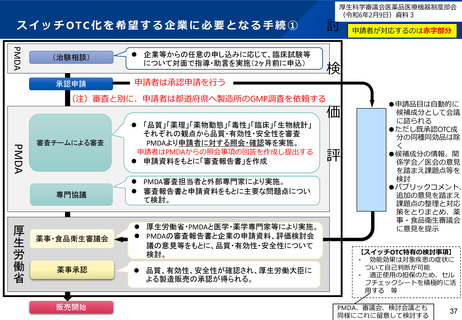
1.スイッチOTCも含む新医薬品の承認審査プロセス
承認及び要指導医薬品の指定等についての大臣
への意見を医学・薬学の専門家から聴取するこ
とが必要であるため(P10、11参照)
①新医薬品等については、薬機法第14条第11項に基づき、厚生労働大臣は、承認につい
て、あらかじめ薬事・食品衛生審議会の意見を聞かなければならないとされている。
②新医薬品等の審査については、薬機法第14条の2の3に基づき、審査機関である
PMDAに審査を行わせることができるとされており、厚生労働大臣は承認をするときに
品質、薬理、薬物動態、臨床等の専門性を有す
PMDAの審査結果を考慮しなければならないとされている。 るPMDAの審査員が、申請資料を基に効能効果
等の妥当性について審査報告書を作成するため
薬機法(抜粋)
第14条第11項 厚生労働大臣は、第一項の承認の申請があつた場合において、申請に係る医薬品、医薬部外品又は化粧品が、既にこの条又は第
十九条の二の承認を与えられている医薬品、医薬部外品又は化粧品と有効成分、分量、用法、用量、効能、効果等が明らかに異なるときは、
同項の承認について、あらかじめ、薬事・食品衛生審議会の意見を聴かなければならない。
第14条の2の3 厚生労働大臣は、機構に、医薬品(専ら動物のために使用されることが目的とされているものを除く。以下この条において同
じ。)、医薬部外品(専ら動物のために使用されることが目的とされているものを除く。以下この条において同じ。)又は化粧品のうち政令
で定めるものについての第十四条の承認のための審査、同条第六項及び第七項(これらの規定を同条第十五項において準用する場合を含
む。)、第九項並びに第十三項(同条第十五項において準用する場合を含む。)、第十四条の二第二項並びに前条第二項(次条第二項におい
て準用する場合を含む。)の規定による調査並びに第十四条の二第三項の規定による基準確認証の交付及び同条第五項の規定による基準確認
証の返還の受付(以下「医薬品等審査等」という。)を行わせることができる。
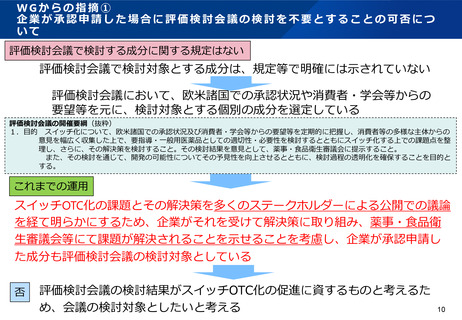
2.評価検討会議については、スイッチOTCの推進に向けて役割を果たすステークホルダー
(業界団体、医療関係者、消費者)が、公開での議論を通じて、スイッチOTCの審査・承
認可否検討の際の論点となる適正使用の確保等の課題とその解決策について整理すること
が目的であり、会議のとりまとめ結果は、重要な参考情報としてPMDAおよび薬事・食品
要指導医薬品の指定等を行う薬事・食品衛生審議会にとって、スイッチOTC
12
衛生審議会における審査に活用されている。推進の役割を担うステークホルダーからの意見は大変参考になるため
ス イ ッ チ OTC 化 の プ ロ セ ス を、 PM DA 、評 価 検討 会 議 、薬 事 ・食 品 衛 生審 議
会に分割している理由及び必要性(1)
1.スイッチOTCも含む新医薬品の承認審査プロセス
承認及び要指導医薬品の指定等についての大臣
への意見を医学・薬学の専門家から聴取するこ
とが必要であるため(P10、11参照)
①新医薬品等については、薬機法第14条第11項に基づき、厚生労働大臣は、承認につい
て、あらかじめ薬事・食品衛生審議会の意見を聞かなければならないとされている。
②新医薬品等の審査については、薬機法第14条の2の3に基づき、審査機関である
PMDAに審査を行わせることができるとされており、厚生労働大臣は承認をするときに
品質、薬理、薬物動態、臨床等の専門性を有す
PMDAの審査結果を考慮しなければならないとされている。 るPMDAの審査員が、申請資料を基に効能効果
等の妥当性について審査報告書を作成するため
薬機法(抜粋)
第14条第11項 厚生労働大臣は、第一項の承認の申請があつた場合において、申請に係る医薬品、医薬部外品又は化粧品が、既にこの条又は第
十九条の二の承認を与えられている医薬品、医薬部外品又は化粧品と有効成分、分量、用法、用量、効能、効果等が明らかに異なるときは、
同項の承認について、あらかじめ、薬事・食品衛生審議会の意見を聴かなければならない。
第14条の2の3 厚生労働大臣は、機構に、医薬品(専ら動物のために使用されることが目的とされているものを除く。以下この条において同
じ。)、医薬部外品(専ら動物のために使用されることが目的とされているものを除く。以下この条において同じ。)又は化粧品のうち政令
で定めるものについての第十四条の承認のための審査、同条第六項及び第七項(これらの規定を同条第十五項において準用する場合を含
む。)、第九項並びに第十三項(同条第十五項において準用する場合を含む。)、第十四条の二第二項並びに前条第二項(次条第二項におい
て準用する場合を含む。)の規定による調査並びに第十四条の二第三項の規定による基準確認証の交付及び同条第五項の規定による基準確認
証の返還の受付(以下「医薬品等審査等」という。)を行わせることができる。
2.評価検討会議については、スイッチOTCの推進に向けて役割を果たすステークホルダー
(業界団体、医療関係者、消費者)が、公開での議論を通じて、スイッチOTCの審査・承
認可否検討の際の論点となる適正使用の確保等の課題とその解決策について整理すること
が目的であり、会議のとりまとめ結果は、重要な参考情報としてPMDAおよび薬事・食品
要指導医薬品の指定等を行う薬事・食品衛生審議会にとって、スイッチOTC
12
衛生審議会における審査に活用されている。推進の役割を担うステークホルダーからの意見は大変参考になるため