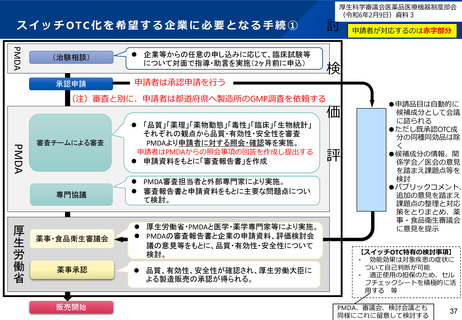
よむ、つかう、まなぶ。
資料1-1 厚生労働省 御提出資料 (37 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/240328/medical09_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第9回 3/28)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
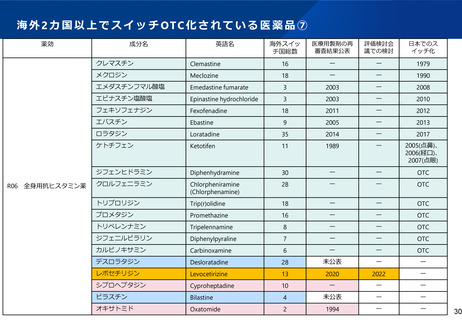
ス イ ッ チ OTC 化 を 希望 す る企 業 に必 要 とな る 手続 ①
PMDA
(治験相談)
企業等からの任意の申し込みに応じて、臨床試験等
について対面で指導・助言を実施(2ヶ月前に申込)
承認申請
申請者は承認申請を行う
PMDA
審査チームによる審査
「品質」「薬理」「薬物動態」「毒性」「臨床」「生物統計」
それぞれの観点から品質・有効性・安全性を審査
PMDAより申請者に対する照会・確認等を実施。
申請者はPMDAからの照会事項の回答を作成し提出する
申請資料をもとに「審査報告書」を作成
専門協議
厚生労働省
薬事・食品衛生審議会
薬事承認
販売開始
PMDA審査担当者と外部専門家により実施。
審査報告書と申請資料をもとに主要な問題点につい
て検討。
厚生労働省・PMDAと医学・薬学専門家等により実施。
PMDAの審査報告書と企業の申請資料、評価検討会
議の意見等をもとに、品質・有効性・安全性について
検討。
品質、有効性、安全性が確認され、厚生労働大臣に
よる製造販売の承認が得られる。
申請者が対応するのは赤字部分
評価検討会議
(注)審査と別に、申請者は都道府県へ製造所のGMP調査を依頼する
厚生科学審議会医薬品医療機器制度部会
(令和6年2月9日)資料3
●申請品目は自動的に
候補成分として会議
に諮られる
●ただし既承認OTC成
分の同種同効品は除
く
●候補成分の情報、関
係学会/医会の意見
を踏まえ課題点等を
検討
●パブリックコメント、
追加の意見を踏まえ
課題点の整理と対応
策をとりまとめ、薬
事・食品衛生審議会
に意見を提示
【スイッチOTC特有の検討事項】
・ 効能効果は対象疾患の症状に
ついて自己判断が可能
・ 適正使用の担保のため、セル
フチェックシートを積極的に活
用する 等
PMDA、審議会、検討会議とも
同様にこれに留意して検討する
37
PMDA
(治験相談)
企業等からの任意の申し込みに応じて、臨床試験等
について対面で指導・助言を実施(2ヶ月前に申込)
承認申請
申請者は承認申請を行う
PMDA
審査チームによる審査
「品質」「薬理」「薬物動態」「毒性」「臨床」「生物統計」
それぞれの観点から品質・有効性・安全性を審査
PMDAより申請者に対する照会・確認等を実施。
申請者はPMDAからの照会事項の回答を作成し提出する
申請資料をもとに「審査報告書」を作成
専門協議
厚生労働省
薬事・食品衛生審議会
薬事承認
販売開始
PMDA審査担当者と外部専門家により実施。
審査報告書と申請資料をもとに主要な問題点につい
て検討。
厚生労働省・PMDAと医学・薬学専門家等により実施。
PMDAの審査報告書と企業の申請資料、評価検討会
議の意見等をもとに、品質・有効性・安全性について
検討。
品質、有効性、安全性が確認され、厚生労働大臣に
よる製造販売の承認が得られる。
申請者が対応するのは赤字部分
評価検討会議
(注)審査と別に、申請者は都道府県へ製造所のGMP調査を依頼する
厚生科学審議会医薬品医療機器制度部会
(令和6年2月9日)資料3
●申請品目は自動的に
候補成分として会議
に諮られる
●ただし既承認OTC成
分の同種同効品は除
く
●候補成分の情報、関
係学会/医会の意見
を踏まえ課題点等を
検討
●パブリックコメント、
追加の意見を踏まえ
課題点の整理と対応
策をとりまとめ、薬
事・食品衛生審議会
に意見を提示
【スイッチOTC特有の検討事項】
・ 効能効果は対象疾患の症状に
ついて自己判断が可能
・ 適正使用の担保のため、セル
フチェックシートを積極的に活
用する 等
PMDA、審議会、検討会議とも
同様にこれに留意して検討する
37