よむ、つかう、まなぶ。
資料1-1 厚生労働省 御提出資料 (14 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/240328/medical09_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第9回 3/28)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
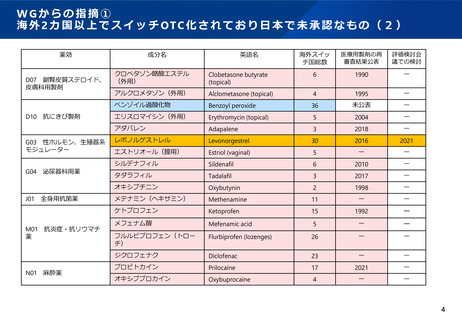
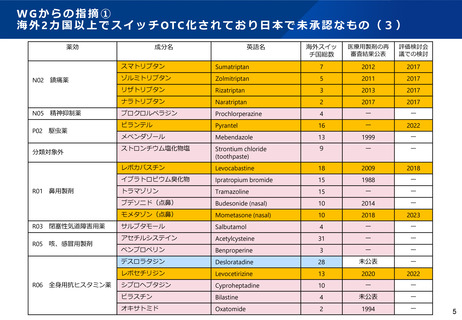
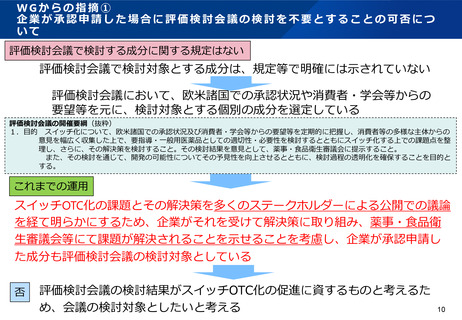
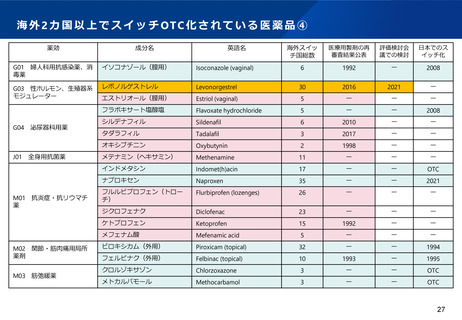
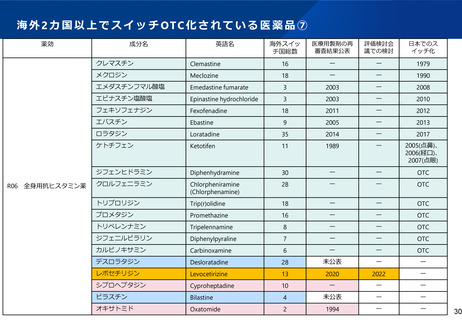
WGからの指摘④-1
PMDA、評価検討会議、薬事・食品衛生審議会の構成員が審査・審議・意思
決定を行う具体的事項、関与する専門家の数・専門性
審査・審議・意思決
定を行う具体的事項
PMDA
一般薬等審査部
評価検討会議
薬事・食品衛生審議会
要指導・一般用医薬品部会
(PMDA審査等業務及び安全対策業務関係業務方法書)
承認のための審査(スイッチOTC)を行う
(評価検討会議開催要綱)
承認可否判断に資するため、スイッ
チOTC化の課題と解決策を検討する
消費者・学会等の要望を定期的に
把握し、
・要指導・一般用医薬品としての適
切性・必要性に関する科学的検討
・要望成分について、スイッチOTC
化する上での課題点の整理、解決
策の検討
・スイッチOTC化における共通の課
題点の解決策、考え方等の検討
・添付文書理解度調査等の新たな評
価手法についての提言等
を行う
(薬機法第14条、薬事分科会規
程)
承認の可否判断を大臣に答申する
承認申請された要指導・一般用医薬品について、
①承認のための審査、②既に製造販売承認を与えら
れている品目との有効成分、分量、用法、用量、効
能、効果等の同一性に関する調査、③必要に応じて
書面又は実地による基準適合性調査※を行う。
要指導・一般用医薬品のうち新規性の高い品目の
審査を行う場合において、承認申請書等に基づき、
複数の担当者による審査を行う必要があると認める
ときは、チームによる審査を行う。チーム審査を行
う品目の審査については、申請者に対する面談を行
うとともに、各分野の専門家から意見を聴くため、
審査専門協議その他必要な専門協議を行う。
関与する専門家の
数・専門性
※
○PMDA職員による審査
通常、審査は一般薬等審査部の2名担当(主担当
1名と主任専門員1名)、製造販売後調査が必要
な場合は市販後担当(1名)も審査に加わる。更
に審査役と審査役補佐が随時サポート。必要に応
じて、新薬審査部の臨床担当、生物統計担当、毒
性担当に相談している。
○専門協議によるアドバイス
(意思決定権はないが、評価の公平性や適正使用推
進の観点からアドバイスを貰う)通常3 ~ 4名
適応症領域を専門とする医師(2~3名)
適正使用推進の観点から薬局薬剤師(1~2名)
安全性、品質等に懸念がある場合は、それぞれ
の当該領域の専門家(各1名)
承認の可否に関する事項、生物由
来製品の指定に関する事項、要指
導医薬品の指定に関する事項、再
審査に係る調査期間の指定並びに
延長に関する事項、再評価に係る
範囲の指定に関する事項、医薬品
の基準に関する事項、毒薬・劇薬
の指定に関する事項を調査審議す
る。
21名
19名
医学(皮膚科、耳鼻咽喉科、眼科、
消化器肝臓内科、呼吸器内科、
外科)
医療関係者(医師会、歯科医師会、
薬剤師会、保険薬局協会)
業界(OTC薬協、チェーンドラッグ
ストア協会)
使用者
医学(消化器内科、呼吸器内科、
内科、心療内科、代謝内分
泌内科、感染症内科、小児
科、皮膚科)
薬学(臨床薬理学、生薬化学、医
療薬学、医薬品情報学、薬
局薬剤師)
使用者
承認申請資料が申請資料の信頼性の基準に従って、試験結果に基づいて適切かつ正確に作成されているかについての調査
14
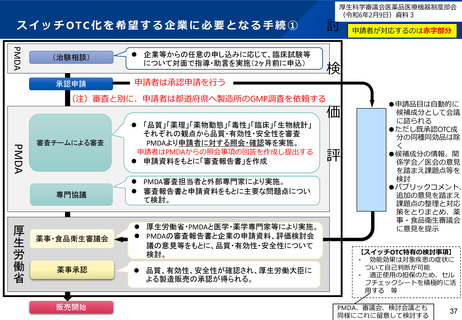
PMDA、評価検討会議、薬事・食品衛生審議会の構成員が審査・審議・意思
決定を行う具体的事項、関与する専門家の数・専門性
審査・審議・意思決
定を行う具体的事項
PMDA
一般薬等審査部
評価検討会議
薬事・食品衛生審議会
要指導・一般用医薬品部会
(PMDA審査等業務及び安全対策業務関係業務方法書)
承認のための審査(スイッチOTC)を行う
(評価検討会議開催要綱)
承認可否判断に資するため、スイッ
チOTC化の課題と解決策を検討する
消費者・学会等の要望を定期的に
把握し、
・要指導・一般用医薬品としての適
切性・必要性に関する科学的検討
・要望成分について、スイッチOTC
化する上での課題点の整理、解決
策の検討
・スイッチOTC化における共通の課
題点の解決策、考え方等の検討
・添付文書理解度調査等の新たな評
価手法についての提言等
を行う
(薬機法第14条、薬事分科会規
程)
承認の可否判断を大臣に答申する
承認申請された要指導・一般用医薬品について、
①承認のための審査、②既に製造販売承認を与えら
れている品目との有効成分、分量、用法、用量、効
能、効果等の同一性に関する調査、③必要に応じて
書面又は実地による基準適合性調査※を行う。
要指導・一般用医薬品のうち新規性の高い品目の
審査を行う場合において、承認申請書等に基づき、
複数の担当者による審査を行う必要があると認める
ときは、チームによる審査を行う。チーム審査を行
う品目の審査については、申請者に対する面談を行
うとともに、各分野の専門家から意見を聴くため、
審査専門協議その他必要な専門協議を行う。
関与する専門家の
数・専門性
※
○PMDA職員による審査
通常、審査は一般薬等審査部の2名担当(主担当
1名と主任専門員1名)、製造販売後調査が必要
な場合は市販後担当(1名)も審査に加わる。更
に審査役と審査役補佐が随時サポート。必要に応
じて、新薬審査部の臨床担当、生物統計担当、毒
性担当に相談している。
○専門協議によるアドバイス
(意思決定権はないが、評価の公平性や適正使用推
進の観点からアドバイスを貰う)通常3 ~ 4名
適応症領域を専門とする医師(2~3名)
適正使用推進の観点から薬局薬剤師(1~2名)
安全性、品質等に懸念がある場合は、それぞれ
の当該領域の専門家(各1名)
承認の可否に関する事項、生物由
来製品の指定に関する事項、要指
導医薬品の指定に関する事項、再
審査に係る調査期間の指定並びに
延長に関する事項、再評価に係る
範囲の指定に関する事項、医薬品
の基準に関する事項、毒薬・劇薬
の指定に関する事項を調査審議す
る。
21名
19名
医学(皮膚科、耳鼻咽喉科、眼科、
消化器肝臓内科、呼吸器内科、
外科)
医療関係者(医師会、歯科医師会、
薬剤師会、保険薬局協会)
業界(OTC薬協、チェーンドラッグ
ストア協会)
使用者
医学(消化器内科、呼吸器内科、
内科、心療内科、代謝内分
泌内科、感染症内科、小児
科、皮膚科)
薬学(臨床薬理学、生薬化学、医
療薬学、医薬品情報学、薬
局薬剤師)
使用者
承認申請資料が申請資料の信頼性の基準に従って、試験結果に基づいて適切かつ正確に作成されているかについての調査
14