よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考
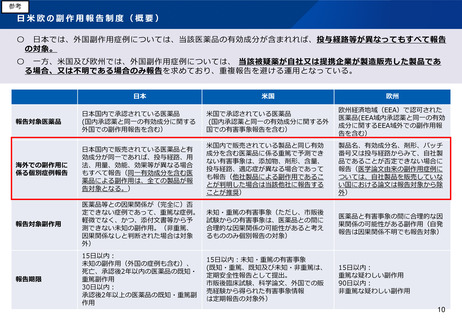
日米欧の副作用報告制度(概要)
〇
日本では、外国副作用症例については、当該医薬品の有効成分が含まれれば、投与経路等が異なってもすべて報告
の対象。
〇
一方、米国及び欧州では、外国副作用症例については、 当該被疑薬が自社又は提携企業が製造販売した製品であ
る場合、又は不明である場合のみ報告を求めており、重複報告を避ける運用となっている。
日本
米国
欧州
報告対象医薬品
日本国内で承認されている医薬品
(国内承認薬と同一の有効成分に関する
外国での副作用報告を含む)
米国で承認されている医薬品
(国内承認薬と同一の有効成分に関する外
国での有害事象報告を含む)
欧州経済地域(EEA)で認可された
医薬品(EEA域内承認薬と同一の有効
成分に関するEEA域外での副作用報
告を含む)
海外での副作用に
係る個別症例報告
日本国内で販売されている医薬品と有
効成分が同一であれば、投与経路、用
法、用量、効能、効果等が異なる場合
もすべて報告(同一有効成分を含む医
薬品による副作用は、全ての製品が報
告対象となる。)
米国内で販売されている製品と同じ有効
成分を含む医薬品に係る重篤で予測でき
ない有害事象は、添加物、剤形、含量、
投与経路、適応症が異なる場合であって
も報告(他社製品による副作用であるこ
とが判明した場合は当該他社に報告する
ことが推奨)
製品名、有効成分名、剤形、バッチ
番号又は投与経路からみて、自社製
品であることが否定できない場合に
報告(医学論文由来の副作用症例に
ついては、自社製品を販売していな
い国における論文は報告対象から除
外)
報告対象副作用
医薬品等との因果関係が(完全に)否
定できない症例であって、重篤な症例。
軽微でなく、かつ、添付文書等から予
測できない未知の副作用。(非重篤、
因果関係なしと判断された場合は対象
外)
未知・重篤の有害事象(ただし、市販後
試験からの有害事象は、医薬品との間に
合理的な因果関係の可能性があると考え
るもののみ個別報告の対象)
医薬品と有害事象の間に合理的な因
果関係の可能性がある副作用(自発
報告は因果関係不明でも報告対象)
報告期限
15日以内:
未知の副作用(外国の症例も含む)、
死亡、承認後2年以内の医薬品の既知・
重篤副作用
30日以内:
承認後2年以上の医薬品の既知・重篤副
作用
15日以内:未知・重篤の有害事象
(既知・重篤、既知及び未知・非重篤は、
定期安全性報告として提出。
市販後臨床試験、科学論文、外国での販
売経験から得られた有害事象情報
は定期報告の対象外)
15日以内:
重篤な疑わしい副作用
90日以内:
非重篤な疑わしい副作用
10
日米欧の副作用報告制度(概要)
〇
日本では、外国副作用症例については、当該医薬品の有効成分が含まれれば、投与経路等が異なってもすべて報告
の対象。
〇
一方、米国及び欧州では、外国副作用症例については、 当該被疑薬が自社又は提携企業が製造販売した製品であ
る場合、又は不明である場合のみ報告を求めており、重複報告を避ける運用となっている。
日本
米国
欧州
報告対象医薬品
日本国内で承認されている医薬品
(国内承認薬と同一の有効成分に関する
外国での副作用報告を含む)
米国で承認されている医薬品
(国内承認薬と同一の有効成分に関する外
国での有害事象報告を含む)
欧州経済地域(EEA)で認可された
医薬品(EEA域内承認薬と同一の有効
成分に関するEEA域外での副作用報
告を含む)
海外での副作用に
係る個別症例報告
日本国内で販売されている医薬品と有
効成分が同一であれば、投与経路、用
法、用量、効能、効果等が異なる場合
もすべて報告(同一有効成分を含む医
薬品による副作用は、全ての製品が報
告対象となる。)
米国内で販売されている製品と同じ有効
成分を含む医薬品に係る重篤で予測でき
ない有害事象は、添加物、剤形、含量、
投与経路、適応症が異なる場合であって
も報告(他社製品による副作用であるこ
とが判明した場合は当該他社に報告する
ことが推奨)
製品名、有効成分名、剤形、バッチ
番号又は投与経路からみて、自社製
品であることが否定できない場合に
報告(医学論文由来の副作用症例に
ついては、自社製品を販売していな
い国における論文は報告対象から除
外)
報告対象副作用
医薬品等との因果関係が(完全に)否
定できない症例であって、重篤な症例。
軽微でなく、かつ、添付文書等から予
測できない未知の副作用。(非重篤、
因果関係なしと判断された場合は対象
外)
未知・重篤の有害事象(ただし、市販後
試験からの有害事象は、医薬品との間に
合理的な因果関係の可能性があると考え
るもののみ個別報告の対象)
医薬品と有害事象の間に合理的な因
果関係の可能性がある副作用(自発
報告は因果関係不明でも報告対象)
報告期限
15日以内:
未知の副作用(外国の症例も含む)、
死亡、承認後2年以内の医薬品の既知・
重篤副作用
30日以内:
承認後2年以上の医薬品の既知・重篤副
作用
15日以内:未知・重篤の有害事象
(既知・重篤、既知及び未知・非重篤は、
定期安全性報告として提出。
市販後臨床試験、科学論文、外国での販
売経験から得られた有害事象情報
は定期報告の対象外)
15日以内:
重篤な疑わしい副作用
90日以内:
非重篤な疑わしい副作用
10