よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考
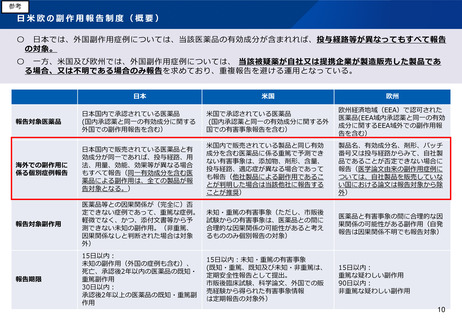
医療機器・再生医療等製品の不具合報告
製造販売業者が規制当局へ報告する副作用/不具合の内容と報告期限
重篤性
医薬品
再生医療等製品/医療機器
国内症例
外国症例
国内症例
外国症例
死亡
15日
15日
15日
15日
重篤
15日
15日
15日
15日
非重篤
集積報告
ー
集積報告
ー
死亡
15日
ー
15日
30日
重篤
30日
ー
30日
30日
非重篤
―
ー
―
ー
使用上の注意等から発生傾
向が予測できない
死亡
15日
15日
15日
15日
重篤
15日
15日
15日
15日
発生傾向の変化が保健衛生
上の危害の発生又は拡大の
おそれを示す
死亡
15日
15日
15日
15日
重篤
15日
15日
15日
15日
使用上の注意から予想
できない
使用上の注意から予想
できる
外国既知重篤(死亡含む)不具合のみ
個別症例の報告要否が異なる
13
医療機器・再生医療等製品の不具合報告
製造販売業者が規制当局へ報告する副作用/不具合の内容と報告期限
重篤性
医薬品
再生医療等製品/医療機器
国内症例
外国症例
国内症例
外国症例
死亡
15日
15日
15日
15日
重篤
15日
15日
15日
15日
非重篤
集積報告
ー
集積報告
ー
死亡
15日
ー
15日
30日
重篤
30日
ー
30日
30日
非重篤
―
ー
―
ー
使用上の注意等から発生傾
向が予測できない
死亡
15日
15日
15日
15日
重篤
15日
15日
15日
15日
発生傾向の変化が保健衛生
上の危害の発生又は拡大の
おそれを示す
死亡
15日
15日
15日
15日
重篤
15日
15日
15日
15日
使用上の注意から予想
できない
使用上の注意から予想
できる
外国既知重篤(死亡含む)不具合のみ
個別症例の報告要否が異なる
13