よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
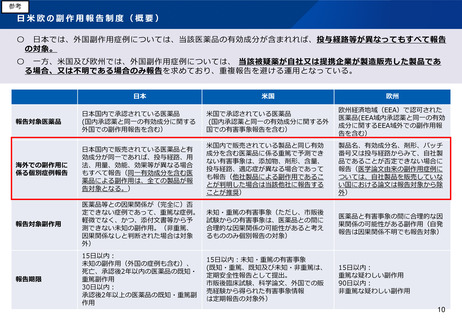
(1)リスクベースドアプローチの推進・RMP(医薬品リスク管理計
画)制度の見直し、(2)RWDの安全対策への利活用の明確化
背景・課題
(医薬品リスク管理計画制度の見直し)
•
先駆的医薬品指定制度、条件付き早期承認制度の法制化により、承認時点で安全性情報が限られる品目の増加、新たな技術を用い
た医薬品の創出を背景として、市販後に収集された情報に基づく通常の安全確保措置に加えて、安全性に関し特に検討すべき事項
をあらかじめ特定し、検出された安全性シグナルに対し迅速かつ計画的に市販後安全対策に取り組む重要性が高まっている。
•
平成26年10月よりGVP省令※の中に医薬品リスク管理計画(RMP)を位置づけて、RMPに基づく活動が必要な品目については、そ
の作成を承認条件として個別に設定し実効性を担保している。しかし、これまで10年近く運用している中で、承認条件として設定
することにより、欧州に比べてやや硬直的な仕組みとなっている。
•
承認条件は必要最小限のものであることが求められるため、再審査時に、RMPに基づく活動の実施内容を確認し、承認条件を解除
する運用となっている。医薬品ライフサイクル全体を通じて、安全性に関する新たな知見に対応する必要がある。
(リアルワールドデータの安全対策への利活用の明確化)
•
RMPの活動の一つである製造販売後の安全監視活動においては、大規模な症例数を対象とした調査や、既存薬等の他剤群、非治療
群などを対照群として設定した調査の実施が容易な製造販売後データベース調査を推進し、リアルワールドデータの活用を図るべ
き。
検討の方向性(案)
※ 医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令
(医薬品リスク管理計画制度の見直し)
•
承認時や製造販売後に得られた知見をもとに、製造販売業者が安全性検討事項に基づく追加の安全性監視活動や追加のリスク最小
化活動の必要性を検討し、必要な場合にRMPの策定や変更を行い、これに基づく活動が実施されるよう、RMPの位置づけを法律上
明確化してはどうか。
•
その際、特に承認直後にRMPに基づく活動が適切に設定され実施されるよう、実効性の担保に留意すべきではないか。
•
さらに、副作用等を広く情報収集し報告する仕組みから、 RMPに基づき計画的に情報収集するアクションの検討に重きを置いた仕
組みに転換し、従来実施してきた市販後安全対策の効果を損なうことなくより必要性の高い部分に重点化し、リスクベースの安全
対策をさらに効果的に実施できる制度の構築を目指すという方向性についてどう考えるか。こうした中で、安全管理責任者の役割
がますます重要となることから、法的位置づけの見直しを含めて検討してはどうか。
(リアルワールドデータの安全対策への利活用の明確化)
•
リアルワールドデータの活用を促進するため、現行の薬機法の再審査申請において、医療機関から直接情報を収集する「使用成績
調査」を想起させる「医薬品の使用成績に関する資料」を添付しなければならないとする規定の見直しを検討してはどうか。
3
画)制度の見直し、(2)RWDの安全対策への利活用の明確化
背景・課題
(医薬品リスク管理計画制度の見直し)
•
先駆的医薬品指定制度、条件付き早期承認制度の法制化により、承認時点で安全性情報が限られる品目の増加、新たな技術を用い
た医薬品の創出を背景として、市販後に収集された情報に基づく通常の安全確保措置に加えて、安全性に関し特に検討すべき事項
をあらかじめ特定し、検出された安全性シグナルに対し迅速かつ計画的に市販後安全対策に取り組む重要性が高まっている。
•
平成26年10月よりGVP省令※の中に医薬品リスク管理計画(RMP)を位置づけて、RMPに基づく活動が必要な品目については、そ
の作成を承認条件として個別に設定し実効性を担保している。しかし、これまで10年近く運用している中で、承認条件として設定
することにより、欧州に比べてやや硬直的な仕組みとなっている。
•
承認条件は必要最小限のものであることが求められるため、再審査時に、RMPに基づく活動の実施内容を確認し、承認条件を解除
する運用となっている。医薬品ライフサイクル全体を通じて、安全性に関する新たな知見に対応する必要がある。
(リアルワールドデータの安全対策への利活用の明確化)
•
RMPの活動の一つである製造販売後の安全監視活動においては、大規模な症例数を対象とした調査や、既存薬等の他剤群、非治療
群などを対照群として設定した調査の実施が容易な製造販売後データベース調査を推進し、リアルワールドデータの活用を図るべ
き。
検討の方向性(案)
※ 医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令
(医薬品リスク管理計画制度の見直し)
•
承認時や製造販売後に得られた知見をもとに、製造販売業者が安全性検討事項に基づく追加の安全性監視活動や追加のリスク最小
化活動の必要性を検討し、必要な場合にRMPの策定や変更を行い、これに基づく活動が実施されるよう、RMPの位置づけを法律上
明確化してはどうか。
•
その際、特に承認直後にRMPに基づく活動が適切に設定され実施されるよう、実効性の担保に留意すべきではないか。
•
さらに、副作用等を広く情報収集し報告する仕組みから、 RMPに基づき計画的に情報収集するアクションの検討に重きを置いた仕
組みに転換し、従来実施してきた市販後安全対策の効果を損なうことなくより必要性の高い部分に重点化し、リスクベースの安全
対策をさらに効果的に実施できる制度の構築を目指すという方向性についてどう考えるか。こうした中で、安全管理責任者の役割
がますます重要となることから、法的位置づけの見直しを含めて検討してはどうか。
(リアルワールドデータの安全対策への利活用の明確化)
•
リアルワールドデータの活用を促進するため、現行の薬機法の再審査申請において、医療機関から直接情報を収集する「使用成績
調査」を想起させる「医薬品の使用成績に関する資料」を添付しなければならないとする規定の見直しを検討してはどうか。
3