よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(3)安全性情報報告制度等の重点化の推進
背景・課題
(感染症定期報告)
•
新型コロナウイルス感染症対応の中で、世界的に伝播する新興感染症の発生時には、時間の経過とともにその態様(感染性、重症度
等)が明らかとなり、新たな変異株の出現など刻一刻と状況が変化することを経験した。
•
一方、感染症定期報告について、最近の報告実態を見ると約80%は主な報告事項がなかったことが明らかになっている。
•
感染症定期報告制度について、感染症の発生時、外国における措置発生時、文献による新たな知見発生時など様々な安全性に関するイ
ベントの発生時に、その都度、集積された最新の知見をもとに安全対策の必要性の検討が行われ、必要な対策が講じられる制度に変更
する必要があるのではないか。
(医薬品の副作用等報告)
•
副作用等報告は以前に比べて増加傾向にあり、2023年度の製薬企業からの国内副作用報告数は、約6.5万件と10年前の1.7倍に増加。
外国症例報告は50万件を超えている。
•
公表文献から得られた外国症例が個別症例報告される場合、情報が十分でないものが、複数の企業から重複して報告される事例もある。
•
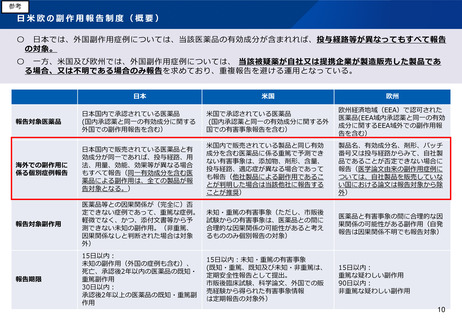
日本では、同一成分が含まれる医薬品による外国症例は、投与経路又は配合成分が異なる場合でもすべて報告対象としている。外国症
例が投与経路又は配合成分が異なる医薬品によるものであり、当該医薬品と同一の投与経路又は配合成分の医薬品が日本で製造販売さ
れている場合、複数企業から報告が重複することとなる。欧米では、他社製品による副作用であることが判明した場合は必ずしも当局
への報告を求めていない。
•
米国では、既知の重篤な副作用は承認後3年以降は1年ごとの定期報告の対象となっている。
(医療機器・再生医療等製品の不具合報告)
•
不具合報告は以前に比べて増加傾向にあり、2023年度の企業からの国内不具合報告数は、2.9万件と10年前の約2倍に増加。外国症例
報告は同時期に約20.5万件報告されている。
•
医療機器・再生医療等製品の不具合報告制度においては、添付文書等から予測可能な既知の不具合であって重篤な外国症例についても
30日以内の報告を求めているところ。他方、医薬品では既知重篤・外国症例については30日以内の報告は求められていない。なお、
直近5年間の医療機器・再生医療等製品の添付文書改訂において、海外症例のみが根拠となった事例は2件あるが、いずれも未知事象
である。
7
背景・課題
(感染症定期報告)
•
新型コロナウイルス感染症対応の中で、世界的に伝播する新興感染症の発生時には、時間の経過とともにその態様(感染性、重症度
等)が明らかとなり、新たな変異株の出現など刻一刻と状況が変化することを経験した。
•
一方、感染症定期報告について、最近の報告実態を見ると約80%は主な報告事項がなかったことが明らかになっている。
•
感染症定期報告制度について、感染症の発生時、外国における措置発生時、文献による新たな知見発生時など様々な安全性に関するイ
ベントの発生時に、その都度、集積された最新の知見をもとに安全対策の必要性の検討が行われ、必要な対策が講じられる制度に変更
する必要があるのではないか。
(医薬品の副作用等報告)
•
副作用等報告は以前に比べて増加傾向にあり、2023年度の製薬企業からの国内副作用報告数は、約6.5万件と10年前の1.7倍に増加。
外国症例報告は50万件を超えている。
•
公表文献から得られた外国症例が個別症例報告される場合、情報が十分でないものが、複数の企業から重複して報告される事例もある。
•
日本では、同一成分が含まれる医薬品による外国症例は、投与経路又は配合成分が異なる場合でもすべて報告対象としている。外国症
例が投与経路又は配合成分が異なる医薬品によるものであり、当該医薬品と同一の投与経路又は配合成分の医薬品が日本で製造販売さ
れている場合、複数企業から報告が重複することとなる。欧米では、他社製品による副作用であることが判明した場合は必ずしも当局
への報告を求めていない。
•
米国では、既知の重篤な副作用は承認後3年以降は1年ごとの定期報告の対象となっている。
(医療機器・再生医療等製品の不具合報告)
•
不具合報告は以前に比べて増加傾向にあり、2023年度の企業からの国内不具合報告数は、2.9万件と10年前の約2倍に増加。外国症例
報告は同時期に約20.5万件報告されている。
•
医療機器・再生医療等製品の不具合報告制度においては、添付文書等から予測可能な既知の不具合であって重篤な外国症例についても
30日以内の報告を求めているところ。他方、医薬品では既知重篤・外国症例については30日以内の報告は求められていない。なお、
直近5年間の医療機器・再生医療等製品の添付文書改訂において、海外症例のみが根拠となった事例は2件あるが、いずれも未知事象
である。
7