よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(3)安全性情報報告制度等の重点化の推進
検討の方向性(案)
(感染症定期報告)
•
感染症定期報告について、原材料に含まれる可能性がある病原体が、ヒトの身体・生命に重大な影響を及ぼす恐
れのあるものであると判明した場合など、リスクが高い場合に速やかに評価・検討結果の報告を求めることとし、
その一方で、対象期間中に報告対象がない場合の報告を不要としてはどうか。
•
ただし、文献報告等の安全管理情報の収集とその記録の保管、安全管理情報に基づく検討とその記録の保管につ
いては、GVP省令上の義務となっていることから、査察等により企業の検討状況を把握し、引き続き、適切な実
施を確保していく。
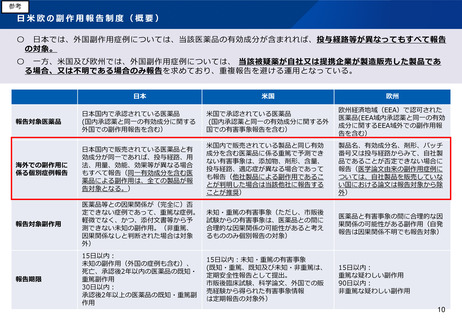
(医薬品の副作用等報告)
•
RMP制度の見直しや国際的な整合性等を踏まえて、複数企業から重複して報告される外国副作用症例の個別報
告(例えば、投与経路又は配合成分が異なる医薬品)等のルールを見直してはどうか。
(医療機器・再生医療等製品の不具合報告)
•
既知の死亡・重篤の外国症例報告について、30日以内の不具合報告を求めているが、現在の医薬品における副作
用報告の仕組みと整合させてはどうか。
8
検討の方向性(案)
(感染症定期報告)
•
感染症定期報告について、原材料に含まれる可能性がある病原体が、ヒトの身体・生命に重大な影響を及ぼす恐
れのあるものであると判明した場合など、リスクが高い場合に速やかに評価・検討結果の報告を求めることとし、
その一方で、対象期間中に報告対象がない場合の報告を不要としてはどうか。
•
ただし、文献報告等の安全管理情報の収集とその記録の保管、安全管理情報に基づく検討とその記録の保管につ
いては、GVP省令上の義務となっていることから、査察等により企業の検討状況を把握し、引き続き、適切な実
施を確保していく。
(医薬品の副作用等報告)
•
RMP制度の見直しや国際的な整合性等を踏まえて、複数企業から重複して報告される外国副作用症例の個別報
告(例えば、投与経路又は配合成分が異なる医薬品)等のルールを見直してはどうか。
(医療機器・再生医療等製品の不具合報告)
•
既知の死亡・重篤の外国症例報告について、30日以内の不具合報告を求めているが、現在の医薬品における副作
用報告の仕組みと整合させてはどうか。
8