よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考
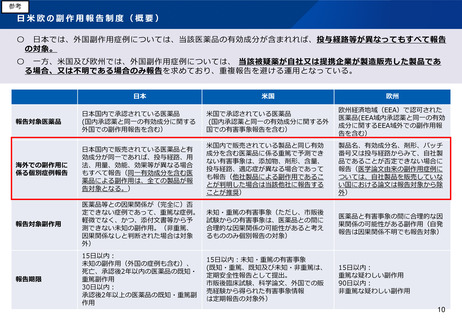
感染症定期報告の制度概要と実態
○ 生物由来製品や再生医療等製品については、その原材料が細胞組織等を含むことから、未知の因子を含めた感染因子(細菌、ウイ
ルス等)を含有している可能性が否定できない。生物由来製品による感染症のリスクは、化学的合成品たる医薬品による副作用と異
なり、
・製品との因果関係が明確になる以前から潜在的に進行し、投薬後一定期間経過後に顕在化するおそれがあり、
・感染した後は、時間の経過に伴い軽減しない場合がある。
○ 従来の個別感染症症例や海外規制等局の措置等にかかる報告に加えて、上記の感染リスクの特徴を踏まえた対応として、製品に直
接的な影響が未だ不明の原料動物等の感染症に関する最新の知見を常に把握し、それを集積したうえで感染症のリスクを多角的に評
価・検討することにより、原材料又は製品による感染リスクの可能性を常に認識するとともに、個別報告の集積による頻度・傾向等
の把握を容易とするよう平成17年度に導入した。
感染症定期報告制度の概要
報告項目
研究報告
感染症の種類別発生状況
及び発生症例一覧
国内の適正使用等確保措
置
外国における措置(品質、
有効性及び安全性に関する事項
その他生物由来製品の適正な使
用のために必要な情報)
その他
報告内容
報告時期
生物由来製品の原材料・原料・材料に係る生物について
報告された、生物から人に感染すると認められる疾病
生物由来製品について報告された、生物から人に感染す
ると認められる疾病
生物由来製品等によるものと疑われる感染症
生物由来製品による保健衛生上の危害の発生・拡大の防
止のために行われた国内での感染症に係る措置
生物由来製品の適正な使用のために行われた国内での措
置
製造・輸入・販売の中止、回収、廃棄等の保健衛生上の
危害の発生又は拡大を防止するための感染症に係る措置
生物由来製品の出荷数量、注意事項等情報、安全性に関
する報告者の見解など
※再生医療等製品についても同様
製造販売
の承認日
等から6月
(厚生労
働大臣が
指定する
生物由来
製品に
あっては、
厚生労働
大臣が指
定する機
関)以内
ごと
感染症定期報告の実態
報告された359件のうち、約80%は主
な報告事項がなかった
内容
件数(割合)
研究報告
69(19.2%)
感染症の症例
13(3.6%)
適正使用等確保措
置
4(1.1%)
3項目すべてにつ
いて報告すべきも
のがなかったと報
告されたもの
289(80.5%)
令和3年7月9日開催令和3年度医薬品等安全対策部会資料4
-1をもとに集計(令和2年12月1日-令和3年3月31日報告分)
令和3年度厚生労働科学研究 次期制度改正を見据えた医薬品
市販後安全対策の再構築に関する研究(研究代表者:成川衛)
9
感染症定期報告の制度概要と実態
○ 生物由来製品や再生医療等製品については、その原材料が細胞組織等を含むことから、未知の因子を含めた感染因子(細菌、ウイ
ルス等)を含有している可能性が否定できない。生物由来製品による感染症のリスクは、化学的合成品たる医薬品による副作用と異
なり、
・製品との因果関係が明確になる以前から潜在的に進行し、投薬後一定期間経過後に顕在化するおそれがあり、
・感染した後は、時間の経過に伴い軽減しない場合がある。
○ 従来の個別感染症症例や海外規制等局の措置等にかかる報告に加えて、上記の感染リスクの特徴を踏まえた対応として、製品に直
接的な影響が未だ不明の原料動物等の感染症に関する最新の知見を常に把握し、それを集積したうえで感染症のリスクを多角的に評
価・検討することにより、原材料又は製品による感染リスクの可能性を常に認識するとともに、個別報告の集積による頻度・傾向等
の把握を容易とするよう平成17年度に導入した。
感染症定期報告制度の概要
報告項目
研究報告
感染症の種類別発生状況
及び発生症例一覧
国内の適正使用等確保措
置
外国における措置(品質、
有効性及び安全性に関する事項
その他生物由来製品の適正な使
用のために必要な情報)
その他
報告内容
報告時期
生物由来製品の原材料・原料・材料に係る生物について
報告された、生物から人に感染すると認められる疾病
生物由来製品について報告された、生物から人に感染す
ると認められる疾病
生物由来製品等によるものと疑われる感染症
生物由来製品による保健衛生上の危害の発生・拡大の防
止のために行われた国内での感染症に係る措置
生物由来製品の適正な使用のために行われた国内での措
置
製造・輸入・販売の中止、回収、廃棄等の保健衛生上の
危害の発生又は拡大を防止するための感染症に係る措置
生物由来製品の出荷数量、注意事項等情報、安全性に関
する報告者の見解など
※再生医療等製品についても同様
製造販売
の承認日
等から6月
(厚生労
働大臣が
指定する
生物由来
製品に
あっては、
厚生労働
大臣が指
定する機
関)以内
ごと
感染症定期報告の実態
報告された359件のうち、約80%は主
な報告事項がなかった
内容
件数(割合)
研究報告
69(19.2%)
感染症の症例
13(3.6%)
適正使用等確保措
置
4(1.1%)
3項目すべてにつ
いて報告すべきも
のがなかったと報
告されたもの
289(80.5%)
令和3年7月9日開催令和3年度医薬品等安全対策部会資料4
-1をもとに集計(令和2年12月1日-令和3年3月31日報告分)
令和3年度厚生労働科学研究 次期制度改正を見据えた医薬品
市販後安全対策の再構築に関する研究(研究代表者:成川衛)
9