よむ、つかう、まなぶ。
【資料2】テーマ②(新技術による医薬品等にも対応したリスクに基づく市販後安全性対策の強化、法違反事例を踏まえた更なる法令遵守や品質確保の取組の実施)について.pdf (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考
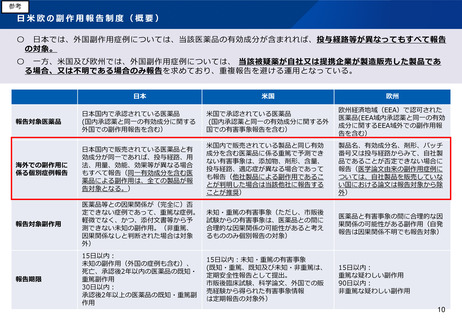
RMP の概要
安全性検討事項
※「重要な潜在的リスク」や「重要な不足情報」に位置づけ、医療機関からの副作用等情報
の収集を促すことが可能。
(1) 重要な特定されたリスク
(2) 重要な潜在的リスク※
(3) 重要な不足情報※
安全性監視計画
リスク最小化計画
通常
不要
追加の措置?
(評価)
・自発報告
(副作用・感染症)
・研究報告
・外国措置報告
・添付文書の作成・改訂
・患者向医薬品ガイド
必要
追加
追加のリスク最小化活動
安全性監視?
リスク最小化?
(評価)
※※安全性定期報告などのタイミングで定期的に報告
※※
追加の安全性監視活動
・市販直後調査
(自発報告の収集強化)
・使用成績調査
・製造販売後データベース
調査
・製造販売後臨床試験
等
・市販直後調査
(確実な情報提供)
・医療関係者への追加
の情報提供
・患者への情報提供
・使用条件の設定
等
ベ
ネ
フ
ィ(
ッ実
ト施
・
リ状
ス況
クの
バ報
ラ告
ン
ス
の)
評
価
6
RMP の概要
安全性検討事項
※「重要な潜在的リスク」や「重要な不足情報」に位置づけ、医療機関からの副作用等情報
の収集を促すことが可能。
(1) 重要な特定されたリスク
(2) 重要な潜在的リスク※
(3) 重要な不足情報※
安全性監視計画
リスク最小化計画
通常
不要
追加の措置?
(評価)
・自発報告
(副作用・感染症)
・研究報告
・外国措置報告
・添付文書の作成・改訂
・患者向医薬品ガイド
必要
追加
追加のリスク最小化活動
安全性監視?
リスク最小化?
(評価)
※※安全性定期報告などのタイミングで定期的に報告
※※
追加の安全性監視活動
・市販直後調査
(自発報告の収集強化)
・使用成績調査
・製造販売後データベース
調査
・製造販売後臨床試験
等
・市販直後調査
(確実な情報提供)
・医療関係者への追加
の情報提供
・患者への情報提供
・使用条件の設定
等
ベ
ネ
フ
ィ(
ッ実
ト施
・
リ状
ス況
クの
バ報
ラ告
ン
ス
の)
評
価
6