よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
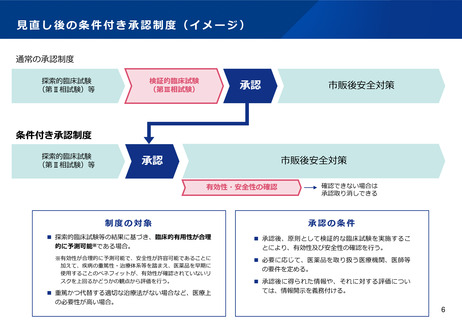
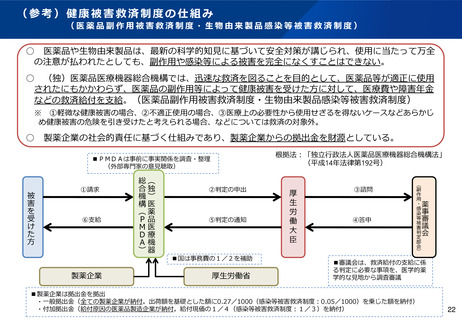
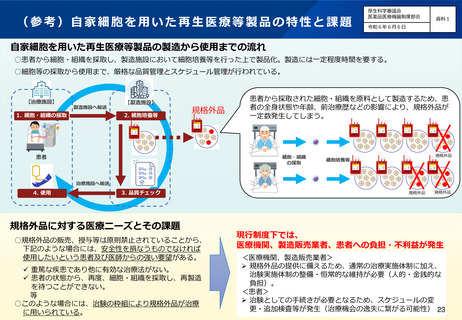
(4)医薬品等の供給不足を踏まえたアクセス改善に向けた制度の見直し
②製造方法等の中リスクの変更カテゴリの追加等
背景・課題
•
後発医薬品を中心とした医薬品の供給不安に対する薬事制度における対応としては、迅速な薬事承認を可能とする体制の確保や変
更手続のあり方を明確化することにより、生産効率の向上等に資することが指摘されている。
•
2023年10月13日に開催された第4回創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会においては、欧
米と同様の中等度変更事項及び年次報告を試行的に導入することなどが了承されたところ。
•
これらの制度的な位置づけについて検討する必要がある。
主な意見
•
欧米に遅れることなく医薬品の製造方法等の変更・改良を行えるよう、短期間の確認で変更ができる中等度変更制度を新たな変更
カテゴリーとして導入いただきたい。
•
薬事申請資料の邦文記載条項や製造販売承認書で管理すべき事項の見直しも必要と考えている。
検討の方向性(案)
•
医薬品の製造方法等に係る一部変更のうち、品質に与える影響が大きくないもの(軽微変更を除く。中等度変更事項という。)に
ついては、一定期間(40日程度を想定)内に迅速に承認することとしてはどうか。
•
医薬品の製造方法等に係る軽微変更のうち、品質に与える影響が少ないものについては、軽微変更届に替えて、1年に1回、その
内容を厚生労働大臣に報告することでよいこととしてはどうか。当該報告については、その内容を厚生労働大臣が確認することと
し、その手数料を設定することとしてはどうか。
11
②製造方法等の中リスクの変更カテゴリの追加等
背景・課題
•
後発医薬品を中心とした医薬品の供給不安に対する薬事制度における対応としては、迅速な薬事承認を可能とする体制の確保や変
更手続のあり方を明確化することにより、生産効率の向上等に資することが指摘されている。
•
2023年10月13日に開催された第4回創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会においては、欧
米と同様の中等度変更事項及び年次報告を試行的に導入することなどが了承されたところ。
•
これらの制度的な位置づけについて検討する必要がある。
主な意見
•
欧米に遅れることなく医薬品の製造方法等の変更・改良を行えるよう、短期間の確認で変更ができる中等度変更制度を新たな変更
カテゴリーとして導入いただきたい。
•
薬事申請資料の邦文記載条項や製造販売承認書で管理すべき事項の見直しも必要と考えている。
検討の方向性(案)
•
医薬品の製造方法等に係る一部変更のうち、品質に与える影響が大きくないもの(軽微変更を除く。中等度変更事項という。)に
ついては、一定期間(40日程度を想定)内に迅速に承認することとしてはどうか。
•
医薬品の製造方法等に係る軽微変更のうち、品質に与える影響が少ないものについては、軽微変更届に替えて、1年に1回、その
内容を厚生労働大臣に報告することでよいこととしてはどうか。当該報告については、その内容を厚生労働大臣が確認することと
し、その手数料を設定することとしてはどうか。
11