よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(2)医療上の必要性の高い医薬品等への早期アクセスの確保
主な意見
•
条件付き承認制度を利用・発展していくというところに賛成だが、承認取消も含めて、市販後にもう一回きちんと治験をするという条件を付
与するのかしないのか等について慎重に検討していただき、安全性確保と有効性について十分検討する必要がある。有効性が確認できない場
合に取り消すことが可能かどうかを検討する必要がある。
•
早期承認、若しくは条件付きで承認された医薬品が、適切に現場で使えるような情報提供や条件を守っているかどうかの確認について、調査
する必要がある。
•
医療上の必要性の高い医薬品への早期アクセスの確保は特に重要だが、あくまでも安全性の確保が前提で、安全性について確認できているこ
と、その上で臨床的有用性が予測可能な場合とすべき。承認を維持することが適切ではないことが判明した場合には、速やかに承認を取り消
すことを可能とする規定は必要。また、未知の重篤なリスクが出たときには迅速な対応ができるようにすることが必要。
•
取消規定を設けることには賛成だが、患者数が少ないなど、いろいろな理由で今までと同じようなRCTが難しく、効果や安全性の評価ができ
ない薬剤についても、いかに効果や安全性を測る手法を高めていくか、どのように大規模RCTに代替する手段を持っていくかというのが大事。
•
医療機器あるいは体外診断用医薬品についても条件付き承認制度があるが、医薬品と同様に必ずしも利用が進んでいないというのが実態だと
認識しており、方向性は同じであるため医療機器等についても是非議論をお願いしたい。
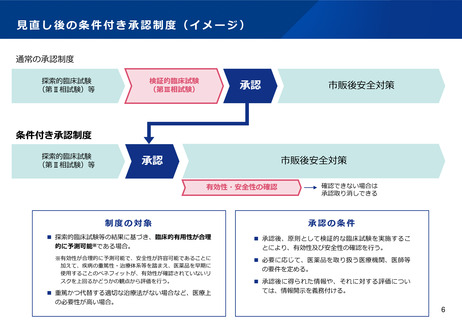
検討の方向性(案)
•
医薬品、医療機器等について、我が国においても、欧米と同様に、取り消し規定を設けた上で、探索的試験の段階で医薬品等を早期に承認す
るベネフィットが、検証的試験が必要であることによるリスクを上回るものに対して、その臨床的有用性が合理的に予測可能な場合に、承認
を与える制度を設けることとしてはどうか(具体的なイメージは次ページ)。
•
また、疾患の重篤性や既存の治療法から医療上の必要性の高い医薬品であって、例えば熱帯病治療薬のように国内での開発が進みにくいもの
や、臨床開発は進められているものの承認までの間の患者アクセスのニーズの高いものについて、米国のsingle patient INDも参考に、拡大
治験の運用改善を検討することとしてはどうか。具体的には、現行のコホート型の拡大治験の手続きの簡素化(症例報告、モニタリング、有
害事象報告、治験薬概要書の取り扱い等)を検討するとともに、すでに治験届が提出されている医薬品について、患者一人を対象とする場合
には特に簡略な手続きにより拡大治験を実施できる運用について、GCP省令改正等の検討を進めることとしてはどうか。
5
主な意見
•
条件付き承認制度を利用・発展していくというところに賛成だが、承認取消も含めて、市販後にもう一回きちんと治験をするという条件を付
与するのかしないのか等について慎重に検討していただき、安全性確保と有効性について十分検討する必要がある。有効性が確認できない場
合に取り消すことが可能かどうかを検討する必要がある。
•
早期承認、若しくは条件付きで承認された医薬品が、適切に現場で使えるような情報提供や条件を守っているかどうかの確認について、調査
する必要がある。
•
医療上の必要性の高い医薬品への早期アクセスの確保は特に重要だが、あくまでも安全性の確保が前提で、安全性について確認できているこ
と、その上で臨床的有用性が予測可能な場合とすべき。承認を維持することが適切ではないことが判明した場合には、速やかに承認を取り消
すことを可能とする規定は必要。また、未知の重篤なリスクが出たときには迅速な対応ができるようにすることが必要。
•
取消規定を設けることには賛成だが、患者数が少ないなど、いろいろな理由で今までと同じようなRCTが難しく、効果や安全性の評価ができ
ない薬剤についても、いかに効果や安全性を測る手法を高めていくか、どのように大規模RCTに代替する手段を持っていくかというのが大事。
•
医療機器あるいは体外診断用医薬品についても条件付き承認制度があるが、医薬品と同様に必ずしも利用が進んでいないというのが実態だと
認識しており、方向性は同じであるため医療機器等についても是非議論をお願いしたい。
検討の方向性(案)
•
医薬品、医療機器等について、我が国においても、欧米と同様に、取り消し規定を設けた上で、探索的試験の段階で医薬品等を早期に承認す
るベネフィットが、検証的試験が必要であることによるリスクを上回るものに対して、その臨床的有用性が合理的に予測可能な場合に、承認
を与える制度を設けることとしてはどうか(具体的なイメージは次ページ)。
•
また、疾患の重篤性や既存の治療法から医療上の必要性の高い医薬品であって、例えば熱帯病治療薬のように国内での開発が進みにくいもの
や、臨床開発は進められているものの承認までの間の患者アクセスのニーズの高いものについて、米国のsingle patient INDも参考に、拡大
治験の運用改善を検討することとしてはどうか。具体的には、現行のコホート型の拡大治験の手続きの簡素化(症例報告、モニタリング、有
害事象報告、治験薬概要書の取り扱い等)を検討するとともに、すでに治験届が提出されている医薬品について、患者一人を対象とする場合
には特に簡略な手続きにより拡大治験を実施できる運用について、GCP省令改正等の検討を進めることとしてはどうか。
5