よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44072.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第7回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
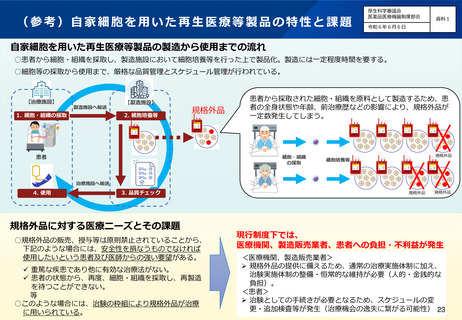
(7)再生医療等製品の特性を踏まえた治療アクセスの改善
背景・課題
•
再生医療等製品については、医薬品・医療機器と同様に、現行法令上は承認の内容と異なる製品(規格外品)
の販売、授与等は原則として禁止されている。
•
患者自身の細胞・組織である自家細胞を用いた再生医療等製品においては、患者の年齢、全身状態などの影響
により、含量や細胞増殖能が承認を受けた規格値を下回るなど、規格外品が一定数発生してしまうことは避け
られない。
•
疾患の重篤性や患者の状態によっては、再製造のための治療機会の先延ばしは大きなリスクとなり、再製造中
に患者の容態が悪化して死に至る場合もある。
•
そのため、患者や医師から規格外品であっても使用したいとの強い要望があることから、臨床現場においては、
治験の枠組を利用した治療が行われている。
•
しかしながら、規格外品を用いた治療に備えた治験実施体制の整備が必要となるなど、通常の治療実施体制に
加えた対応が必要となることから、医療機関、製造販売業者双方の負担となるだけではなく、治験に必要とな
る各種手続きのためのスケジュール変更など、患者にも不利益が生じる可能性がある。
主な意見
•
救済制度や医療行為としての安全確保等との整合性などについて、整理していただきたい。
•
一様に規格外品を使っていいとするのではなく、患者それぞれの症例や重篤性、状態に合わせて、満たすべき
要件が慎重に考えられていくべき。
•
例外的な取扱いであるため、本来するべき製造管理の工程が甘くならないような制度設計をすべき。
20
背景・課題
•
再生医療等製品については、医薬品・医療機器と同様に、現行法令上は承認の内容と異なる製品(規格外品)
の販売、授与等は原則として禁止されている。
•
患者自身の細胞・組織である自家細胞を用いた再生医療等製品においては、患者の年齢、全身状態などの影響
により、含量や細胞増殖能が承認を受けた規格値を下回るなど、規格外品が一定数発生してしまうことは避け
られない。
•
疾患の重篤性や患者の状態によっては、再製造のための治療機会の先延ばしは大きなリスクとなり、再製造中
に患者の容態が悪化して死に至る場合もある。
•
そのため、患者や医師から規格外品であっても使用したいとの強い要望があることから、臨床現場においては、
治験の枠組を利用した治療が行われている。
•
しかしながら、規格外品を用いた治療に備えた治験実施体制の整備が必要となるなど、通常の治療実施体制に
加えた対応が必要となることから、医療機関、製造販売業者双方の負担となるだけではなく、治験に必要とな
る各種手続きのためのスケジュール変更など、患者にも不利益が生じる可能性がある。
主な意見
•
救済制度や医療行為としての安全確保等との整合性などについて、整理していただきたい。
•
一様に規格外品を使っていいとするのではなく、患者それぞれの症例や重篤性、状態に合わせて、満たすべき
要件が慎重に考えられていくべき。
•
例外的な取扱いであるため、本来するべき製造管理の工程が甘くならないような制度設計をすべき。
20